Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page
1.
Introduction
Maîtriser les thèmes « Chimie » et « Chimie
organique » avant d’aborder le thème « Biochimie ».

Sélectionner
l’affirmation exacte :
1- Aucuns
points communs biochimiques entre une bactérie et un être humain
2- L’eau,
molécule polarisée et permettant l’établissement de multiples liaisons
hydrogène à faibles énergies, est le solvant du vivant
3- Les
biomolécules ne contiennent pas souvent des atomes de carbone, d’oxygène, ou
d’hydrogène
4- Les
cellules organiques ne comportent pas d’éléments génétiques
L’affirmation
2 est exacte.
Rappels :
Biochimie
La biochimie, chimie du
vivant, est l’étude :
- Des
molécules qui constituent les êtres vivants,
- Des
transformations, des réactions chimiques,
à l’intérieur des molécules et des cellules
du vivant.
Organismes
vivants
La vie
est l’état donné aux formes auto organisées de la matière capables d’évolutions (métabolisme), de réactions aux stimuli, de reproductions.
Malgré
l’immense diversité des organismes vivants, une unicité
biochimique les caractérise :
- Même types de molécules (biomolécules) et des mécanismes métaboliques,
-
Constitués en une ou d’un assemblage de cellules,
- L’eau est le solvant de leurs molécules,
-
Similitudes de leurs macromolécules (lipides, protéines, etc.) et de leurs
métabolites (petites molécules),
- Autres
points communs : ADN, enzymes
catalysant les réactions, …
Biomolécules
Les
principales catégories de molécules étudiées en biochimie sont :
- Les glucides, (sucres/oses,
exemple : glucose)
4 kilocalories/gramme
Utilisation
énergétique et stockage flexible
- Les lipides, (du Grec « Lipos » :
graisse)
9 kilocalories/gramme
Constitution
de réserves énergétiques,
Utilisation
dynamique lourde (c’est le cas de le dire !)
- Les protéines,
4 kilocalories/gramme
Utilisation
exceptionnelle pour la production d’énergie
Circulent sous forme d’acide aminés.
- Les acides nucléiques (bases de l’ADN/ARN).
Page 2.
Biochimie &
Biomolécules
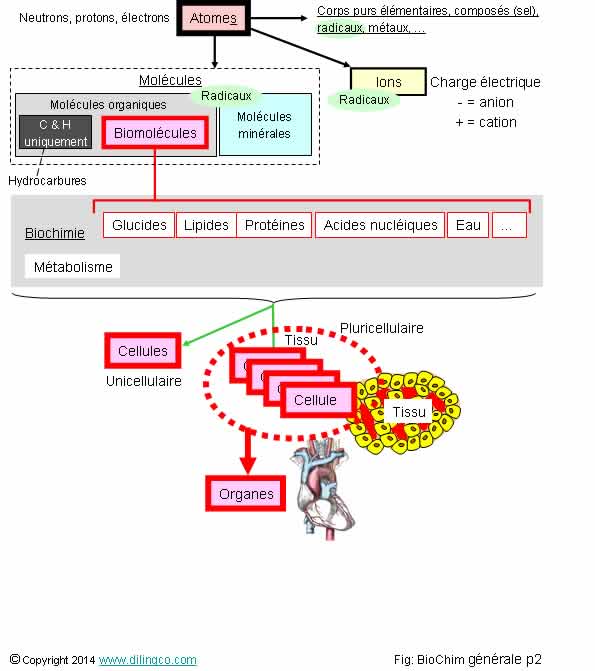
Sélectionnez
les deux affirmations exactes :
1- Un
radical est un composé chimique très stable
2- Une
biomolécule participe au métabolisme d’un organisme vivant
3- La
biochimie étudie les réactions chimiques au sein des cellules et des
biomolécules
4- Les
biomolécules ne sont pas essentiellement composées de carbone, d’hydrogène,
d’oxygène et d’azote
5- Les
lipides, du grec « lipos », correspondent à la famille des sucres
Les
affirmations 2 et 3 sont exactes.
Affirmation
1
Non.
Radical :
- espèce
chimique (atome, molécule, ion),
- 1 ou plusieurs électron(s) célibataire(s) sur sa couche externe,
- très instable (durée de vie très courte en solution),
- ne
respecte pas la règle de l’octet,
- se note
par un point (A.)
Exemples :
Monoxyde
d’azote NO., radical méthyle .CH3, radical
hydrogène H., …
Voir chapitre Radicaux
Affirmation
2
Oui.
Métabolisme en
biologie : ensemble des transformations
moléculaires et énergétiques qui se déroulent dans une cellule ou un organisme vivant.
Affirmation
4
Non.
99% des atomes des molécules présentes dans le corps sont des atomes de :
- Carbone,
- Hydrogène,
- Oxygène,
- Azote,
- Phosphore,
- Souffre.
Affirmation
5
Non.
Lipides,
du grec « Lipos », graisses.
Glucides, sucres, aussi appelés hydrates de
carbone
(Formule
globale : Cn (H2O)n )
Rappels :
La biochimie est l’étude :
- Des
molécules qui constituent les êtres vivants,
- Des
transformations, des réactions chimiques,
à l’intérieur des molécules et des cellules
du vivant.
Molécules
organiques
Molécules
à base de carbone et d’hydrogène.
Autres
éléments pouvant être contenus dans les molécules organiques :
Azote,
oxygène, phosphore, soufre, halogènes, etc.
Hydrocarbures = composés uniquement de carbone et d’hydrogène
(Comme le
mot ‘hydrocarbure’ l’indique)
Biomolécules
(Molécules
biologiques)
Molécules
organiques qui composent les cellules du vivant.
Suivant
la complexité, la masse moléculaire, on classe les biomolécules en :
- Métabolites (petites molécules),
- Macromolécules, molécules de grandes tailles et
de masse moléculaire élevée.
Métabolisme
Processus des transformations moléculaires et énergétiques qui se déroulent dans la cellule
ou l’organisme considéré.
Page 3.
Métabolisme
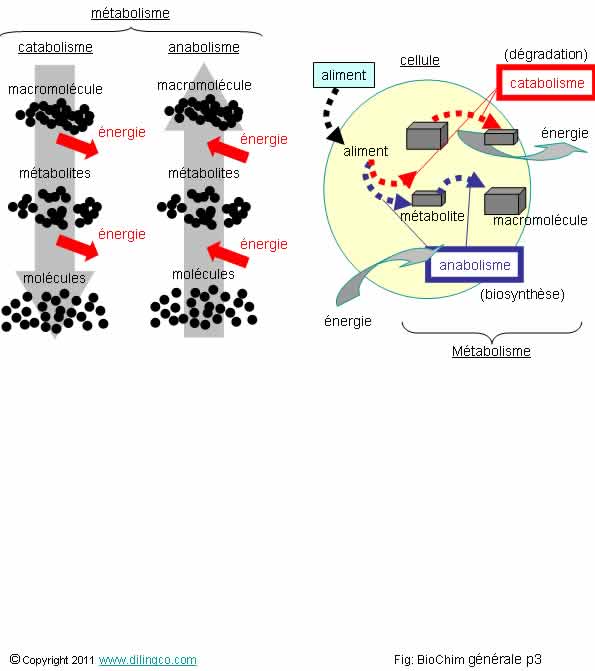
Sélectionnez
l’affirmation fausse :
1- Le
catabolisme et l’anabolisme sont les deux composantes du métabolisme
2-
Catabolisme : dégradation de grosses molécules (appelées macromolécules)
en petites molécules (appelées métabolites)
3- La
dégradation moléculaire (catabolisme), libère de l’énergie
4- Les
processus de biochimie n’obéissent pas aux lois habituelles de chimie et de
physique
L’affirmation
4 est fausse.
Rappels :
La biologie peut se diviser en grandes disciplines :
- L’énergétique, production d’énergie de la cellule,
- L’enzymologie, étude des catalyseurs biologiques,
- Le métabolisme, divisé en anabolisme et catabolisme.
Métabolisme
Le métabolisme est l’ensemble des processus des transformations
moléculaires et énergétiques qui se déroulent dans les cellules ou l’organisme
considéré.
Les deux composantes du métabolisme :
- Le catabolisme, réactions de dégradation et de
production d’énergie,
- L’anabolisme, réactions de synthèse de la
cellule.
Catabolisme
Le catabolisme est l’ensemble des réactions chimiques
de dégradations moléculaires.
Les
réactions de catabolisme sont :
- des oxydations chimiques (ou deshydrogénations),
- exoénergétiques
(productrices d’énergie).
Anabolisme
L’anabolisme est l’ensemble des réactions chimiques de
synthèses qui permettent à une cellule de synthétiser
les éléments indispensables à sa vie ou à sa fonction.
Anabolisme = biosynthèse
Les
réactions d’anabolisme sont :
- des réductions chimiques,
- endoénergétiques
(qui consomment de l’énergie).
Biomolécules
(Molécules
biologiques)
Molécules
organiques qui composent les cellules du vivant.
Suivant
la complexité, la masse moléculaire, on classe les biomolécules en :
- Métabolites (petites molécules),
- Macromolécules, molécules de grandes tailles et
de masse moléculaire élevée.
Les processus de biochimie obéissent aux lois chimiques et
physiques qui régissent tous les processus de l’univers.
Les
techniques et principes des autres disciplines sont utilisés par la biochimie.
Exemples :
- Nomenclature de la chimie organique,
- Thermodynamique pour l’étude des réactions
chimiques,
- Diffraction des rayons X pour l’étude tridimensionnelle des macromolécules,
-
Informatique pour l’analyse des séquences nucléotidiques,
- etc.
Page 4.
Métabolites /
Macromolécules
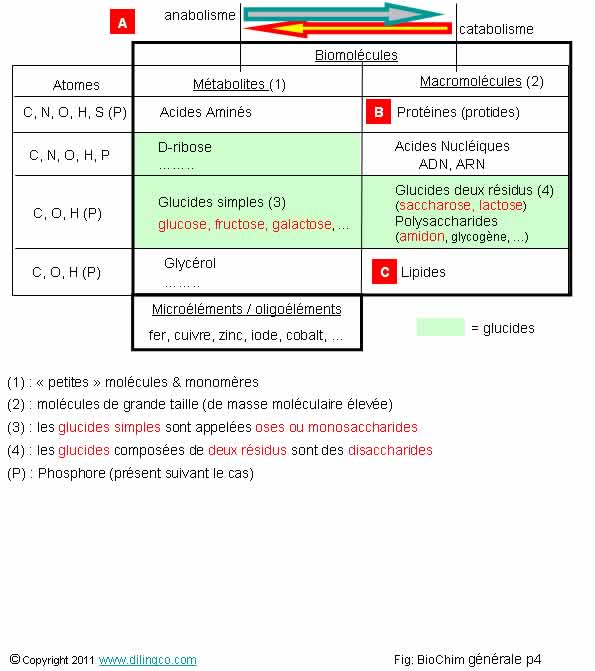
Sélectionnez
les trois affirmations exactes :
1- Les
petites molécules, à faible masse moléculaire, et les molécules monomères, sont
classées dans les « métabolites » (figure 1)
2-
D-glucose et glycérol sont des macromolécules (figure 2)
3-
[A] : La synthèse de macromolécules à partir de métabolites s’appelle le
catabolisme
4-
[A] : La synthèse de macromolécules à partir de métabolites s’appelle
l’anabolisme
5-
[C] : Le catabolisme des lipides donne du glycérol, des acides gras
6-
[B] : Le catabolisme des protides donne des acides nucléiques
7- La
famille des glucides ne contient que des glucides simples (des oses), tel que
le glucose
Les
affirmations 1, 4 et 5 sont exactes.
Affirmation
2
Non.
D-Glucose
et glycérol sont des métabolites
Affirmation
6
Non.
La
dégradation des protéines donne des acides aminés.
Affirmation
7
Non.
La
répartition des glucides est :
Les oses
(sucres simples monosaccharides) :
Le glucose est le principal représentant des oses.
Les
osides (sucres complexes, di, tri &
polysaccharides) :
Les
osides sont des polymères d’oses.
Rappels :
Suivant
la complexité, la masse moléculaire, on classe les biomolécules en :
- Métabolites (petites molécules),
- Macromolécules, molécules de grandes tailles et
de masse moléculaire élevée.
Éléments
chimiques
Un petit
nombre d’éléments chimiques (27), rentrent dans la composition des
biomolécules.
Les plus
importants :
- Oxygènes, O, z=8, pourcentage de la masse
corporelle : (65%)
(Dont un
très grand pourcentage dans l’eau, H2O,
constituant principal de l’organisme)
- Carbone, C, 6, (18,5%)
- Hydrogène, H, 1, (9,5%)
- Azote, N, 7, (3,5%)
-
Calcium, Ca, 20, (1,5%)
-
Phosphore, P, 15, (1%)
Note :
Les 4
premiers éléments, O,C, H, N, représente 96%
de la masse corporelle.
Oligoéléments
Les microéléments,
aussi appelés oligoéléments, existent à l’état de
trace dans notre organisme.
Exemples :
- Fer, traces dans l’hémoglobine,
- Zinc et cations divalents pour la structure de certaines enzymes,
- Iode, constituant essentiel de certaines hormones produites par la glande thyroïde,
- Cobalt et la vitamine
B12
Page 5.
Métabolismes glucides
lipides
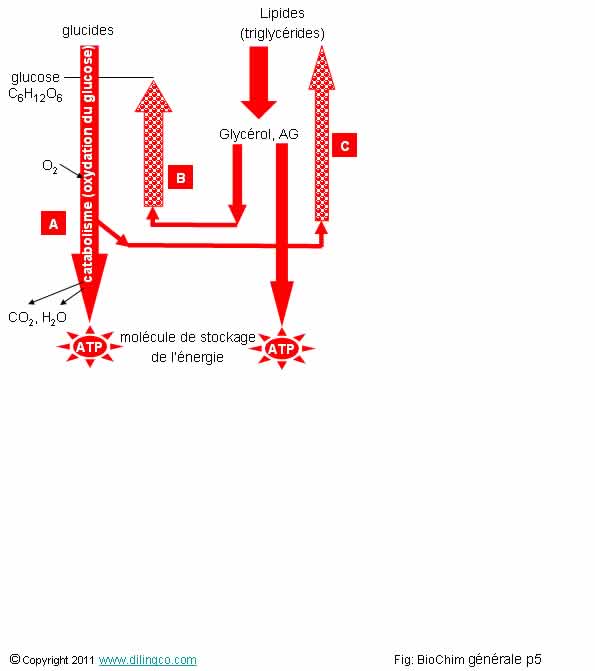
Sélectionner les
deux affirmations
exactes :
1- [A] :
le glucose perd tous ses hydrogènes pour se transformer en molécules de CO2,
d’eau, et d’ATP : processus de catabolisme et d’oxydation
2-
[B] : L’organisme a un besoin permanent de glucose. L’organisme peut le
synthétiser (biosynthèse, à partir du glycérol par exemple) : processus
d’anabolisme
3- [C] : Un processus d’anabolisme dégage de l’énergie
4- Les
glucides ne peuvent pas être transformées en lipides (graisses) par l’organisme
5- Les
graisses ne peuvent pas se dégrader en glycérol, glucose, et énergie
Les
affirmations 1 et 2 sont exactes.
Rappels :
ATP : molécule adénosine triphosphate
L’ATP est
une molécule qui fonctionne comme un réservoir à
énergie.
Page 6.
Réserves d’énergie
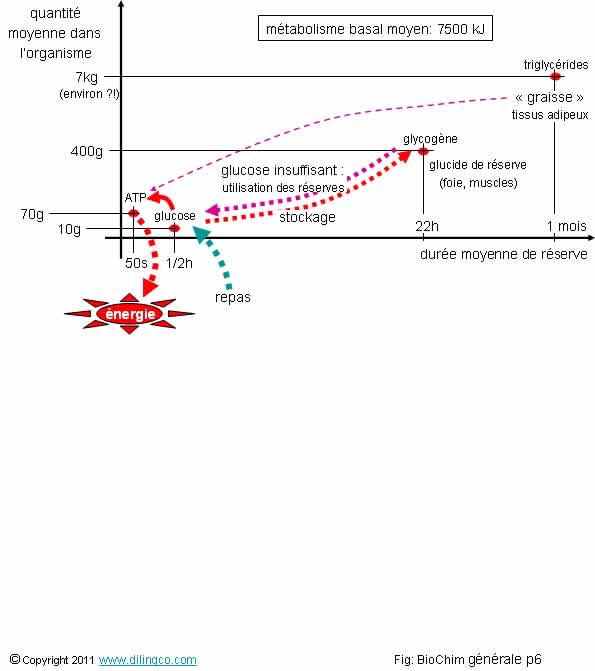
Sélectionner
les trois affirmations exactes :
1- Le stockage
du glucose en glycogène résout l’adaptation le l’apports d’énergies exogènes
variables, aux besoins d’énergie réguliers et fluctuants de l’organisme
2- Molécules
d’ATP : molécules utilisées par l’organisme pour fournir l’énergie à
toutes les réactions qui en ont besoins
3-
L’organisme utilise en premier les triglycérides des tissus adipeux pour créer
les molécules d’ATP dont il a un besoin minimum constant et impératif
4- Les
molécules d’ATP ne constituent pas des réserves d’énergie pour l’organisme
5- Le
glycogène est la réserve de substrat énergétique utilisée en cas de jeûne
prolongé
6- Le
glycogène se dégrade très facilement en glucose ; l’oxydation du glucose
est la voie royale pour produire des molécules d’ATP
Les
affirmations 1, 2 et 6 sont exactes.
Affirmation
3
Non.
Les processus de dégradation des triglycérides
(TG) en molécules énergétiques exploitables, et de transport de ces molécules
aux organes qui ont besoin, sont trop complexes et
ne sont pas assez réactifs pour être
utilisés en premières sources d’énergie par l’organisme.
Affirmation
4
Si,
Mais la
faible quantité de molécules d’ATP n’est pas une très grosse réserves (quelques
dizaines de secondes !)
Page 7.
Atomes du vivant
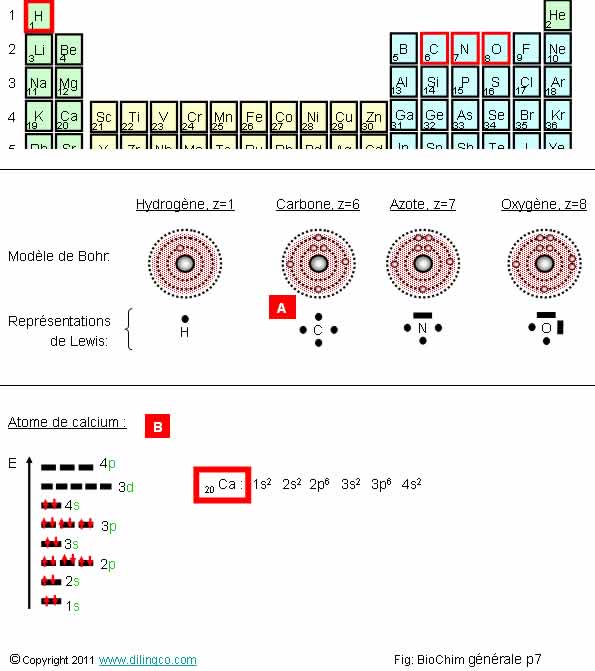
Sélectionner
l’affirmation exacte :
1- Les
atomes du vivant, O, C, H, N, ont un fort numéro atomique et ont besoin de
beaucoup d’électrons pour compléter leur couche externe
2-
L’hydrogène présent dans toutes les molécules organiques y est principalement
lié à des atomes C, O, N
3-
[A] : L’atome de carbone a quatre électrons
4-
[B] : Atome de chrome représenté en modèle quantique. Note : compter
et vérifier le nombre d’électrons
L’affirmation
2 est exacte.
Affirmation
1
Non.
Atomes de
faibles numéros atomiques.
Petits
atomes capables de compléter leur couche externe : respect de la règle de
l’octet et stabilité.
H, z=1 =
1 électron. 1 électron pour compléter sa couche de valence.
C, z=6 =
6 électrons. 4 électrons pour compléter sa couche de valence.
N, z=7 =
7 électrons. 3 électrons pour compléter sa couche de valence.
O, z=8 =
8 électrons. 2 électrons pour compléter sa couche de valence.
Affirmation
3
Non.
L’atome
de carbone à 6 électrons (numéro atomique : z=6).
La
représentation de Lewis présente les électrons de valence mais ne représente
pas les électrons de cœur.
Le modèle
de Bohr est valide jusqu'à z<19.
Le modèle
quantique de Schrödinger
est à utiliser pour les atomes avec plus d’électrons.
Révisions :
Revoir le thème « Chimie ».
Affirmation
4
Non.
Total :
20 électrons.
L’atome représenté est celui du calcium.
Révisions :
Revoir le thème « Chimie ».
Rappels :
Les
biomolécules sont constituées principalement des « quatre
atomes du vivant » :
- Carbone,
- Hydrogène,
- Oxygène,
- Azote.
Ces
éléments, C, H, O, N, représentent 96% de la masse corporelle.
Dans le
corps on trouve aussi du :
- Calcium, Ca, 20, (1,5%),
- Phosphore, P, 15, (1%),
et des micro-éléments,
appelés aussi oligoéléments, tells que l’or, le fer, le zinc.
Page 8.
Rappels. Atome de carbone
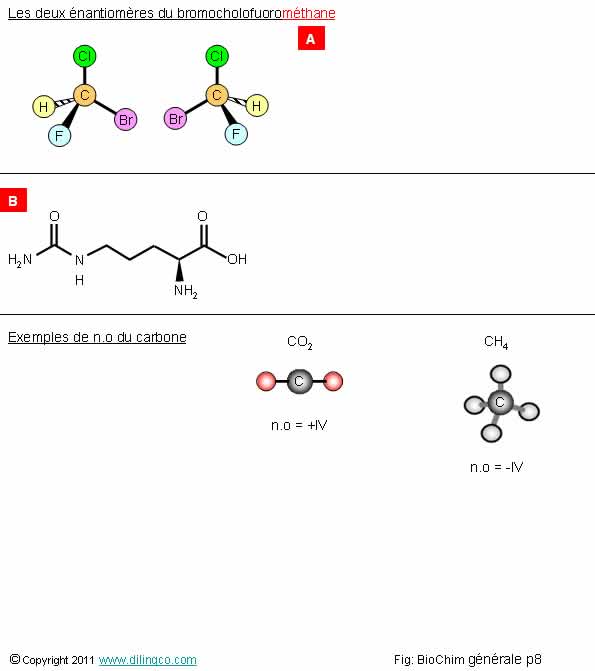
Sélectionner
l’affirmation exacte :
1- [A] :
Des molécules énantiomères (isomères et chirales) ont toujours des effets
physiologiques identiques
2 –
[A] : Le nom de la molécule se termine en « méthane » : méth
= 1 carbone, ane = alcane = que des liaisons simples
3-
[B] : pas d’atomes de carbone dans cette molécule
4- Les
liaisons simples carbone/carbone sont figées dans l’espace : les
biomolécules ont des structures spatiales, des squelettes, rigides
L’affirmation
2 est exacte.
Affirmation
1
Non.
Les deux
molécules carbonées tétraédriques, bien que chimiquement identiques, peuvent
avoir des effets physiologiques différents, voire antagonistes, sur des
systèmes biologiques sensibles aux formes chirales des molécules.
Exemples
d’effets : arômes différents.
Rappels :
Molécules isomères :
Même formule brute mais formules semi développées ou développées différentes.
Molécules chirales :
Isomères
dont l’une des formes est superposable à l’image
de l’autre dans un miroir.
Elles correspondent aux mêmes éléments chimiques et portent le
même nom.
Enantiomère : isomère et chirale
Pour se
rappeler :
Les mains
sont énantiomères (les deux formes sont superposables dans un miroir.
Affirmation
3
Si.
En chimie
organique on ne représente pas les atomes de carbone.
Les atomes de carbone sont présents à chaque angle ou interception de la
représentation.
Ici :
- 6
atomes de carbone,
- Deux
doubles liaisons avec des oxygènes,
- Le
groupement NH2 est en avant du plan principal de la molécule.
Note :
- Il est
rare d’avoir une triple liaison dans une biomolécule.
Affirmation
4
Non.
Au
contraire, les liaisons simples autour d’un atome de carbone ont une liberté de
rotation. Ceci explique les multiples conformations possibles des biomolécules
ayant un grand nombre d’atomes de carbone et de liaisons simples.
Les liaisons
doubles sont beaucoup plus rigides.
Rappels :
A
retenir :
- Le carbone constitue le squelette des biomolécules.
- Les énantiomères peuvent avoir des propriétés biologiques
différentes.
- Une
biomolécule complexe peut avoir de multiples
conformations.
- Le
carbone, par ses divers degrés d’oxydation, sert
de source d’électrons dans les réactions redox des cellules
Nombre
d’oxydation
Le
nombre d’oxydation (ou « degré d’oxydation »), et son calcul, sont
détaillés dans le thème « Chimie/Redox –calcul
n.o, cas général ».
Dans le
cas général :
- Le
nombre d’oxydation de l’oxygène est
égal à moins deux
(n.o O = -II)
- Le
nombre d’oxydation de l’hydrogène est
égal à plus un
(n.o H = +I)
Le nombre
d’oxydation est exprimé en chiffres romains
pour le différentier de la charge d’un ion réel.
Gaz
carbonique :
Charge de
la molécule CO2 = 0
Charge
des 2 atomes d’oxygène = 2 x (-2) = -4
Le nombre
d’oxydation n.o du carbone dans CO2 est donc de :
0 – (-4)
= n.o = +IV
Méthane :
Charge de
la molécule de méthane CH4= 0
Charge
des 4 atomes d’hydrogène = 4 x (+1) = +4
Le nombre
d’oxydation n.o du carbone dans CH4 est donc de :
0 – (+4)
n.o = -IV
Page 9.
Eau et termes utiles
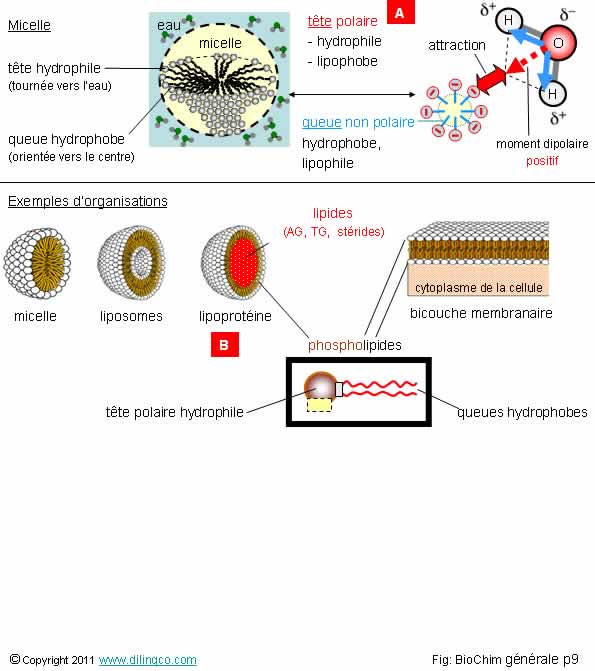
Sélectionner
l’affirmation exacte :
1-
[A] : La molécule d’eau n’est pas polarisée : atome d’oxygène entre 2
hydrogènes = moment dipolaire résultant nul = pas d’attraction avec les têtes
négatives
2- Toutes
les vitamines sont hydrosolubles. Il n’existe pas de vitamines liposolubles
3- [B] : micelle
4- Une
liaison hydrogène peut s’établir entre un atome d’hydrogène est un atome autre
que l’oxygène. Exemple : H - N
L’affirmation
4 est exacte.
Affirmation
1
Si.
Le dipôle
électrique résultant n’est pas nul.
La polarisation de la molécule d’eau permet la formation d’une
liaison hydrogène avec une autre molécule polaire ou un ion voisin.
Les liaisons hydrogène, liaisons électrostatiques à faibles énergies, entre les
molécules d’eau ont des durées très courtes ; ceci explique la fluidité de
l’eau dans son état liquide.
Affirmation
2
Si.
Les
vitamines des groupes B et C sont hydrosolubles.
Les
vitamines des groupes A, D, E et K, sont liposolubles.
Rappels :
AG : Acides gras
TG : Triglycérides
L’eau est le constituant principal des êtres vivants.
L’eau est le solvant du vivant : Tous les organismes vivants sont des
systèmes chimiques en phase aqueuse.
Caractéristiques
importantes
Les
propriétés de l’eau découlent de deux caractéristiques :
- La
structure de molécule d’eau conduit à une molécule
polarisée,
- La
molécule d’eau peut établir des liaisons hydrogène
de nature électrostatique
Propriétés
principales de l’eau
- Force de cohésion élevée,
- établie
des liaisons hydrogène avec des atomes des biomolécules,
- grand pouvoir de solvatation sur les solutés polaires
ou ioniques,
- se dissocie en ion oxonium/hydronium H3O+
et en ion hydroxyde OH-
Le pH, fonction du rapport de ces ions, agit sur l’action des
enzymes dans l’estomac et l’intestin.
- l’état liquide à une densité supérieure à l’état
solide : la glace flotte sur l’eau,
- tension superficielle élevée. Ceci explique la
capillarité (la sève monte dans les plantes), ou que des insectes puissent
marcher sur l’eau.
Ne pas
confondre
Hydratation
Addition de l’eau à une molécule.
Hydrolyse
Coupure d’une molécule sous l’action de l’eau.
Note :
Il existe aussi des hydrolyses chimiques (en milieu acide), et enzymatiques.
Déshydratation (ou condensation)
Perte d’une molécule d’eau.
Solvatation (dispersion)
La
solvatation résulte de :
-
l’interaction électrostatique de l’eau avec des solutés
ionisables,
-
l’interaction dipôle-dipôle ou liaisons hydrogènes
dans le cas de solutés non ionisables mais
polarisés.
Micelle
Une
micelle est un agrégat sphérique de molécules amphiphiles.
Les têtes
hydrophiles sont dirigées vers l’extérieur, vers le solvant ; les chaînes
hydrophobes sont dirigées vers l’intérieur de la micelle.
La taille
des vésicules micelles est de l’ordre de 0,001 à 0,3 micron.
Amphiphile : hydrophile ou hydrophobe à la fois (suivant le cas).
Liposome
Même
principe de création que les micelles mais l’agrégat
est formé de bicouches graisseuses concentriques.
Lipoprotéine : enrobage
sphérique d’un noyau hydrophobe (lipides insolubles dans le sang), dans une coque recouverte de groupement polaires
hydrophiles permettant l’acheminement
de l’ensemble dans le système sanguin.
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Introduction
Maîtriser les thèmes « Chimie » et « Chimie organique » avant d’aborder le thème « Biochimie ».

Sélectionner l’affirmation exacte :
1- Aucuns points communs biochimiques entre une bactérie et un être humain
2- L’eau, molécule polarisée et permettant l’établissement de multiples liaisons hydrogène à faibles énergies, est le solvant du vivant
3- Les biomolécules ne contiennent pas souvent des atomes de carbone, d’oxygène, ou d’hydrogène
4- Les cellules organiques ne comportent pas d’éléments génétiques
L’affirmation 2 est exacte.
Rappels :
Biochimie
La biochimie, chimie du vivant, est l’étude :
- Des molécules qui constituent les êtres vivants,
- Des transformations, des réactions chimiques, à l’intérieur des molécules et des cellules du vivant.
Organismes vivants
La vie est l’état donné aux formes auto organisées de la matière capables d’évolutions (métabolisme), de réactions aux stimuli, de reproductions.
Malgré l’immense diversité des organismes vivants, une unicité biochimique les caractérise :
- Même types de molécules (biomolécules) et des mécanismes métaboliques,
- Constitués en une ou d’un assemblage de cellules,
- L’eau est le solvant de leurs molécules,
- Similitudes de leurs macromolécules (lipides, protéines, etc.) et de leurs métabolites (petites molécules),
- Autres points communs : ADN, enzymes catalysant les réactions, …
Biomolécules
Les principales catégories de molécules étudiées en biochimie sont :
- Les glucides, (sucres/oses, exemple : glucose)
4 kilocalories/gramme
Utilisation énergétique et stockage flexible
- Les lipides, (du Grec « Lipos » : graisse)
9 kilocalories/gramme
Constitution de réserves énergétiques,
Utilisation dynamique lourde (c’est le cas de le dire !)
- Les protéines,
4 kilocalories/gramme
Utilisation
exceptionnelle pour la production d’énergie
Circulent sous forme d’acide aminés.
- Les acides nucléiques (bases de l’ADN/ARN).
Page 2.
Biochimie & Biomolécules

Sélectionnez les deux affirmations exactes :
1- Un radical est un composé chimique très stable
2- Une biomolécule participe au métabolisme d’un organisme vivant
3- La biochimie étudie les réactions chimiques au sein des cellules et des biomolécules
4- Les biomolécules ne sont pas essentiellement composées de carbone, d’hydrogène, d’oxygène et d’azote
5- Les lipides, du grec « lipos », correspondent à la famille des sucres
Les affirmations 2 et 3 sont exactes.
Affirmation 1
Non.
Radical :
- espèce chimique (atome, molécule, ion),
- 1 ou plusieurs électron(s) célibataire(s) sur sa couche externe,
- très instable (durée de vie très courte en solution),
- ne respecte pas la règle de l’octet,
- se note par un point (A.)
Exemples :
Monoxyde d’azote NO., radical méthyle .CH3, radical hydrogène H., …
Voir chapitre Radicaux
Affirmation 2
Oui.
Métabolisme en biologie : ensemble des transformations moléculaires et énergétiques qui se déroulent dans une cellule ou un organisme vivant.
Affirmation 4
Non.
99% des atomes des molécules présentes dans le corps sont des atomes de :
- Carbone,
- Hydrogène,
- Oxygène,
- Azote,
- Phosphore,
- Souffre.
Affirmation 5
Non.
Lipides, du grec « Lipos », graisses.
Glucides, sucres, aussi appelés hydrates de carbone
(Formule globale : Cn (H2O)n )
Rappels :
La biochimie est l’étude :
- Des molécules qui constituent les êtres vivants,
- Des transformations, des réactions chimiques, à l’intérieur des molécules et des cellules du vivant.
Molécules organiques
Molécules à base de carbone et d’hydrogène.
Autres éléments pouvant être contenus dans les molécules organiques :
Azote, oxygène, phosphore, soufre, halogènes, etc.
Hydrocarbures = composés uniquement de carbone et d’hydrogène
(Comme le mot ‘hydrocarbure’ l’indique)
Biomolécules
(Molécules biologiques)
Molécules organiques qui composent les cellules du vivant.
Suivant la complexité, la masse moléculaire, on classe les biomolécules en :
- Métabolites (petites molécules),
- Macromolécules, molécules de grandes tailles et de masse moléculaire élevée.
Métabolisme
Processus des transformations moléculaires et énergétiques qui se déroulent dans la cellule ou l’organisme considéré.
Page 3.
Métabolisme

Sélectionnez l’affirmation fausse :
1- Le catabolisme et l’anabolisme sont les deux composantes du métabolisme
2- Catabolisme : dégradation de grosses molécules (appelées macromolécules) en petites molécules (appelées métabolites)
3- La dégradation moléculaire (catabolisme), libère de l’énergie
4- Les processus de biochimie n’obéissent pas aux lois habituelles de chimie et de physique
L’affirmation 4 est fausse.
Rappels :
La biologie peut se diviser en grandes disciplines :
- L’énergétique, production d’énergie de la cellule,
- L’enzymologie, étude des catalyseurs biologiques,
- Le métabolisme, divisé en anabolisme et catabolisme.
Métabolisme
Le métabolisme est l’ensemble des processus des transformations moléculaires et énergétiques qui se déroulent dans les cellules ou l’organisme considéré.
Les deux composantes du métabolisme :
- Le catabolisme, réactions de dégradation et de production d’énergie,
- L’anabolisme, réactions de synthèse de la cellule.
Catabolisme
Le catabolisme est l’ensemble des réactions chimiques de dégradations moléculaires.
Les réactions de catabolisme sont :
- des oxydations chimiques (ou deshydrogénations),
- exoénergétiques (productrices d’énergie).
Anabolisme
L’anabolisme est l’ensemble des réactions chimiques de synthèses qui permettent à une cellule de synthétiser les éléments indispensables à sa vie ou à sa fonction.
Anabolisme = biosynthèse
Les réactions d’anabolisme sont :
- des réductions chimiques,
- endoénergétiques (qui consomment de l’énergie).
Biomolécules
(Molécules biologiques)
Molécules organiques qui composent les cellules du vivant.
Suivant la complexité, la masse moléculaire, on classe les biomolécules en :
- Métabolites (petites molécules),
- Macromolécules, molécules de grandes tailles et de masse moléculaire élevée.
Les processus de biochimie obéissent aux lois chimiques et physiques qui régissent tous les processus de l’univers.
Les techniques et principes des autres disciplines sont utilisés par la biochimie.
Exemples :
- Nomenclature de la chimie organique,
- Thermodynamique pour l’étude des réactions chimiques,
- Diffraction des rayons X pour l’étude tridimensionnelle des macromolécules,
- Informatique pour l’analyse des séquences nucléotidiques,
- etc.
Page 4.
Métabolites / Macromolécules

Sélectionnez les trois affirmations exactes :
1- Les petites molécules, à faible masse moléculaire, et les molécules monomères, sont classées dans les « métabolites » (figure 1)
2- D-glucose et glycérol sont des macromolécules (figure 2)
3- [A] : La synthèse de macromolécules à partir de métabolites s’appelle le catabolisme
4- [A] : La synthèse de macromolécules à partir de métabolites s’appelle l’anabolisme
5- [C] : Le catabolisme des lipides donne du glycérol, des acides gras
6- [B] : Le catabolisme des protides donne des acides nucléiques
7- La famille des glucides ne contient que des glucides simples (des oses), tel que le glucose
Les affirmations 1, 4 et 5 sont exactes.
Affirmation 2
Non.
D-Glucose et glycérol sont des métabolites
Affirmation 6
Non.
La dégradation des protéines donne des acides aminés.
Affirmation 7
Non.
La répartition des glucides est :
Les oses (sucres simples monosaccharides) :
Le glucose est le principal représentant des oses.
Les osides (sucres complexes, di, tri & polysaccharides) :
Les osides sont des polymères d’oses.
Rappels :
Suivant la complexité, la masse moléculaire, on classe les biomolécules en :
- Métabolites (petites molécules),
- Macromolécules, molécules de grandes tailles et de masse moléculaire élevée.
Éléments chimiques
Un petit nombre d’éléments chimiques (27), rentrent dans la composition des biomolécules.
Les plus importants :
- Oxygènes, O, z=8, pourcentage de la masse corporelle : (65%)
(Dont un très grand pourcentage dans l’eau, H2O, constituant principal de l’organisme)
- Carbone, C, 6, (18,5%)
- Hydrogène, H, 1, (9,5%)
- Azote, N, 7, (3,5%)
- Calcium, Ca, 20, (1,5%)
- Phosphore, P, 15, (1%)
Note :
Les 4 premiers éléments, O,C, H, N, représente 96% de la masse corporelle.
Oligoéléments
Les microéléments, aussi appelés oligoéléments, existent à l’état de trace dans notre organisme.
Exemples :
- Fer, traces dans l’hémoglobine,
- Zinc et cations divalents pour la structure de certaines enzymes,
- Iode, constituant essentiel de certaines hormones produites par la glande thyroïde,
- Cobalt et la vitamine
B12
Page 5.
Métabolismes glucides lipides

Sélectionner les deux affirmations exactes :
1- [A] : le glucose perd tous ses hydrogènes pour se transformer en molécules de CO2, d’eau, et d’ATP : processus de catabolisme et d’oxydation
2-
[B] : L’organisme a un besoin permanent de glucose. L’organisme peut le
synthétiser (biosynthèse, à partir du glycérol par exemple) : processus
d’anabolisme
3- [C] : Un processus d’anabolisme dégage de l’énergie
4- Les glucides ne peuvent pas être transformées en lipides (graisses) par l’organisme
5- Les graisses ne peuvent pas se dégrader en glycérol, glucose, et énergie
Les affirmations 1 et 2 sont exactes.
Rappels :
ATP : molécule adénosine triphosphate
L’ATP est une molécule qui fonctionne comme un réservoir à énergie.
Page 6.
Réserves d’énergie

Sélectionner les trois affirmations exactes :
1- Le stockage du glucose en glycogène résout l’adaptation le l’apports d’énergies exogènes variables, aux besoins d’énergie réguliers et fluctuants de l’organisme
2- Molécules d’ATP : molécules utilisées par l’organisme pour fournir l’énergie à toutes les réactions qui en ont besoins
3- L’organisme utilise en premier les triglycérides des tissus adipeux pour créer les molécules d’ATP dont il a un besoin minimum constant et impératif
4- Les molécules d’ATP ne constituent pas des réserves d’énergie pour l’organisme
5- Le glycogène est la réserve de substrat énergétique utilisée en cas de jeûne prolongé
6- Le glycogène se dégrade très facilement en glucose ; l’oxydation du glucose est la voie royale pour produire des molécules d’ATP
Les affirmations 1, 2 et 6 sont exactes.
Affirmation 3
Non.
Les processus de dégradation des triglycérides
(TG) en molécules énergétiques exploitables, et de transport de ces molécules
aux organes qui ont besoin, sont trop complexes et
ne sont pas assez réactifs pour être
utilisés en premières sources d’énergie par l’organisme.
Affirmation 4
Si,
Mais la faible quantité de molécules d’ATP n’est pas une très grosse réserves (quelques dizaines de secondes !)
Page 7.
Atomes du vivant

Sélectionner l’affirmation exacte :
1- Les atomes du vivant, O, C, H, N, ont un fort numéro atomique et ont besoin de beaucoup d’électrons pour compléter leur couche externe
2- L’hydrogène présent dans toutes les molécules organiques y est principalement lié à des atomes C, O, N
3- [A] : L’atome de carbone a quatre électrons
4-
[B] : Atome de chrome représenté en modèle quantique. Note : compter
et vérifier le nombre d’électrons
L’affirmation 2 est exacte.
Affirmation 1
Non.
Atomes de faibles numéros atomiques.
Petits atomes capables de compléter leur couche externe : respect de la règle de l’octet et stabilité.
H, z=1 = 1 électron. 1 électron pour compléter sa couche de valence.
C, z=6 = 6 électrons. 4 électrons pour compléter sa couche de valence.
N, z=7 = 7 électrons. 3 électrons pour compléter sa couche de valence.
O, z=8 = 8 électrons. 2 électrons pour compléter sa couche de valence.
Affirmation 3
Non.
L’atome de carbone à 6 électrons (numéro atomique : z=6).
La représentation de Lewis présente les électrons de valence mais ne représente pas les électrons de cœur.
Le modèle de Bohr est valide jusqu'à z<19.
Le modèle quantique de Schrödinger est à utiliser pour les atomes avec plus d’électrons.
Révisions :
Revoir le thème « Chimie ».
Affirmation 4
Non.
Total :
20 électrons.
L’atome représenté est celui du calcium.
Révisions :
Revoir le thème « Chimie ».
Rappels :
Les biomolécules sont constituées principalement des « quatre atomes du vivant » :
- Carbone,
- Hydrogène,
- Oxygène,
- Azote.
Ces éléments, C, H, O, N, représentent 96% de la masse corporelle.
Dans le corps on trouve aussi du :
- Calcium, Ca, 20, (1,5%),
- Phosphore, P, 15, (1%),
et des micro-éléments, appelés aussi oligoéléments, tells que l’or, le fer, le zinc.
Page 8.
Rappels. Atome de carbone

Sélectionner l’affirmation exacte :
1- [A] : Des molécules énantiomères (isomères et chirales) ont toujours des effets physiologiques identiques
2 – [A] : Le nom de la molécule se termine en « méthane » : méth = 1 carbone, ane = alcane = que des liaisons simples
3- [B] : pas d’atomes de carbone dans cette molécule
4- Les liaisons simples carbone/carbone sont figées dans l’espace : les biomolécules ont des structures spatiales, des squelettes, rigides
L’affirmation 2 est exacte.
Affirmation 1
Non.
Les deux molécules carbonées tétraédriques, bien que chimiquement identiques, peuvent avoir des effets physiologiques différents, voire antagonistes, sur des systèmes biologiques sensibles aux formes chirales des molécules.
Exemples d’effets : arômes différents.
Rappels :
Molécules isomères :
Même formule brute mais formules semi développées ou développées différentes.
Molécules chirales :
Isomères dont l’une des formes est superposable à l’image de l’autre dans un miroir.
Elles correspondent aux mêmes éléments chimiques et portent le même nom.
Enantiomère : isomère et chirale
Pour se rappeler :
Les mains sont énantiomères (les deux formes sont superposables dans un miroir.
Affirmation 3
Si.
En chimie
organique on ne représente pas les atomes de carbone.
Les atomes de carbone sont présents à chaque angle ou interception de la
représentation.
Ici :
- 6 atomes de carbone,
- Deux doubles liaisons avec des oxygènes,
- Le groupement NH2 est en avant du plan principal de la molécule.
Note :
- Il est rare d’avoir une triple liaison dans une biomolécule.
Affirmation 4
Non.
Au contraire, les liaisons simples autour d’un atome de carbone ont une liberté de rotation. Ceci explique les multiples conformations possibles des biomolécules ayant un grand nombre d’atomes de carbone et de liaisons simples.
Les liaisons doubles sont beaucoup plus rigides.
Rappels :
A retenir :
- Le carbone constitue le squelette des biomolécules.
- Les énantiomères peuvent avoir des propriétés biologiques différentes.
- Une biomolécule complexe peut avoir de multiples conformations.
- Le carbone, par ses divers degrés d’oxydation, sert de source d’électrons dans les réactions redox des cellules
Nombre d’oxydation
Le nombre d’oxydation (ou « degré d’oxydation »), et son calcul, sont détaillés dans le thème « Chimie/Redox –calcul n.o, cas général ».
Dans le cas général :
- Le nombre d’oxydation de l’oxygène est égal à moins deux
(n.o O = -II)
- Le nombre d’oxydation de l’hydrogène est égal à plus un
(n.o H = +I)
Le nombre d’oxydation est exprimé en chiffres romains pour le différentier de la charge d’un ion réel.
Gaz carbonique :
Charge de la molécule CO2 = 0
Charge des 2 atomes d’oxygène = 2 x (-2) = -4
Le nombre d’oxydation n.o du carbone dans CO2 est donc de :
0 – (-4) = n.o = +IV
Méthane :
Charge de la molécule de méthane CH4= 0
Charge des 4 atomes d’hydrogène = 4 x (+1) = +4
Le nombre d’oxydation n.o du carbone dans CH4 est donc de :
0 – (+4) n.o = -IV
Page 9.
Eau et termes utiles

Sélectionner l’affirmation exacte :
1- [A] : La molécule d’eau n’est pas polarisée : atome d’oxygène entre 2 hydrogènes = moment dipolaire résultant nul = pas d’attraction avec les têtes négatives
2- Toutes
les vitamines sont hydrosolubles. Il n’existe pas de vitamines liposolubles
3- [B] : micelle
4- Une liaison hydrogène peut s’établir entre un atome d’hydrogène est un atome autre que l’oxygène. Exemple : H - N
L’affirmation 4 est exacte.
Affirmation 1
Si.
Le dipôle électrique résultant n’est pas nul.
La polarisation de la molécule d’eau permet la formation d’une
liaison hydrogène avec une autre molécule polaire ou un ion voisin.
Les liaisons hydrogène, liaisons électrostatiques à faibles énergies, entre les
molécules d’eau ont des durées très courtes ; ceci explique la fluidité de
l’eau dans son état liquide.
Affirmation 2
Si.
Les vitamines des groupes B et C sont hydrosolubles.
Les vitamines des groupes A, D, E et K, sont liposolubles.
Rappels :
AG : Acides gras
TG : Triglycérides
L’eau est le constituant principal des êtres vivants.
L’eau est le solvant du vivant : Tous les organismes vivants sont des systèmes chimiques en phase aqueuse.
Caractéristiques importantes
Les propriétés de l’eau découlent de deux caractéristiques :
- La structure de molécule d’eau conduit à une molécule polarisée,
- La molécule d’eau peut établir des liaisons hydrogène de nature électrostatique
Propriétés principales de l’eau
- Force de cohésion élevée,
- établie des liaisons hydrogène avec des atomes des biomolécules,
- grand pouvoir de solvatation sur les solutés polaires ou ioniques,
- se dissocie en ion oxonium/hydronium H3O+ et en ion hydroxyde OH-
Le pH, fonction du rapport de ces ions, agit sur l’action des enzymes dans l’estomac et l’intestin.
- l’état liquide à une densité supérieure à l’état solide : la glace flotte sur l’eau,
- tension superficielle élevée. Ceci explique la capillarité (la sève monte dans les plantes), ou que des insectes puissent marcher sur l’eau.
Ne pas confondre
Hydratation
Addition de l’eau à une molécule.
Hydrolyse
Coupure d’une molécule sous l’action de l’eau.
Note :
Il existe aussi des hydrolyses chimiques (en milieu acide), et enzymatiques.
Déshydratation (ou condensation)
Perte d’une molécule d’eau.
Solvatation (dispersion)
La solvatation résulte de :
- l’interaction électrostatique de l’eau avec des solutés ionisables,
- l’interaction dipôle-dipôle ou liaisons hydrogènes dans le cas de solutés non ionisables mais polarisés.
Micelle
Une micelle est un agrégat sphérique de molécules amphiphiles.
Les têtes hydrophiles sont dirigées vers l’extérieur, vers le solvant ; les chaînes hydrophobes sont dirigées vers l’intérieur de la micelle.
La taille des vésicules micelles est de l’ordre de 0,001 à 0,3 micron.
Amphiphile : hydrophile ou hydrophobe à la fois (suivant le cas).
Liposome
Même principe de création que les micelles mais l’agrégat est formé de bicouches graisseuses concentriques.
Lipoprotéine : enrobage sphérique d’un noyau hydrophobe (lipides insolubles dans le sang), dans une coque recouverte de groupement polaires hydrophiles permettant l’acheminement de l’ensemble dans le système sanguin.