Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Énergie. Stockage &
restitution
Sélectionner
l’affirmation exacte:
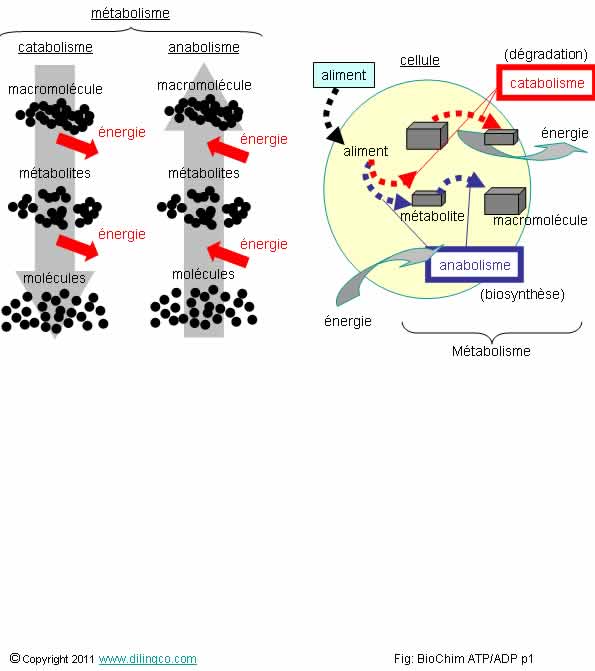
1- Les
principes de la thermodynamique ne s’appliquent pas à la biochimie
2- ADP :
molécule d’adénosine triphosphate
3- [B] :
La réaction d’hydrolyse de l’ATP est une réaction d’hydratation
4-
[A] : Catabolisme : processus division moléculaire exothermique
L’affirmation
4 est exacte.
Affirmation
1
Si.
Les
principes de la thermodynamique s’appliquent à la biochimie
Affirmation
2
Non.
ADP : molécule d’adénosine diphosphate
ATP : adénosine triphosphate
L’ATP est
la molécule de stockage d’énergie de notre organisme.
L’hydrolyse de l’ATP est très exergonique.
L’énergie restituée est utilisée, par couplage,
par des réactions endergoniques, qui ont besoin d’énergie, pour se réaliser.
Affirmation
3
Non.
[B] :
Hydrolyse, division de la molécule d’ATP, par des enzymes ATPases.
Ne pas
confondre
Hydratation
Addition de l’eau à une molécule.
Hydrolyse
Définition
par défaut : Coupure d’une molécule
sous l’action de l’eau.
Mais, il
existe aussi des hydrolyses chimiques (en milieu acide), et enzymatiques.
Exemple :
hydrolyse de l’ATP par des enzymes ATPases.
Déshydratation (ou condensation)
Perte d’une molécule d’eau.
Solvatation (dispersion)
La
solvatation résulte de :
-
l’interaction électrostatique de l’eau avec des solutés
ionisables,
-
l’interaction dipôle-dipôle ou liaisons hydrogènes
dans le cas de solutés non ionisables mais
polarisés.
Affirmation
4
Oui.
[A] :
Catabolisme :
processus division moléculaire exothermique.
Exemples :
- catabolisme
du glucose en molécules d’ATP, de CO2, d’H2O,
-
catabolisme de la molécule d’ATP en molécule d’ADP
(Catabolisme :
perte d’un PI, phosphate inorganique ; voir
pages ci-après)
Rappels :
Métabolisme
Le métabolisme est l’ensemble des processus des transformations
moléculaires et énergétiques qui se déroulent dans les cellules ou l’organisme
considéré.
Les deux composantes du métabolisme :
- Le catabolisme, réactions de dégradation et de
production d’énergie,
- L’anabolisme, réactions de synthèse de la
cellule.
Catabolisme
Le catabolisme est l’ensemble des réactions chimiques
de dégradations moléculaires.
Les
réactions de catabolisme sont :
- des oxydations chimiques (ou deshydrogénations),
- exoénergétiques
(productrices d’énergie).
Anabolisme
L’anabolisme est l’ensemble des réactions chimiques de
synthèses qui permettent à une cellule de synthétiser
les éléments indispensables à sa vie ou à sa fonction.
Anabolisme = biosynthèse
Les
réactions d’anabolisme sont :
- des réductions chimiques,
- endoénergétiques
(qui consomment de l’énergie).
Biomolécules
(Molécules
biologiques)
Molécules
organiques qui composent les cellules du vivant.
Suivant
la complexité, la masse moléculaire, on classe les biomolécules en :
- Métabolites (petites molécules),
- Macromolécules, molécules de grandes tailles et
de masse moléculaire élevée.
Page 2.
Exergonique. Endergonique.
Catalyse
Sélectionner
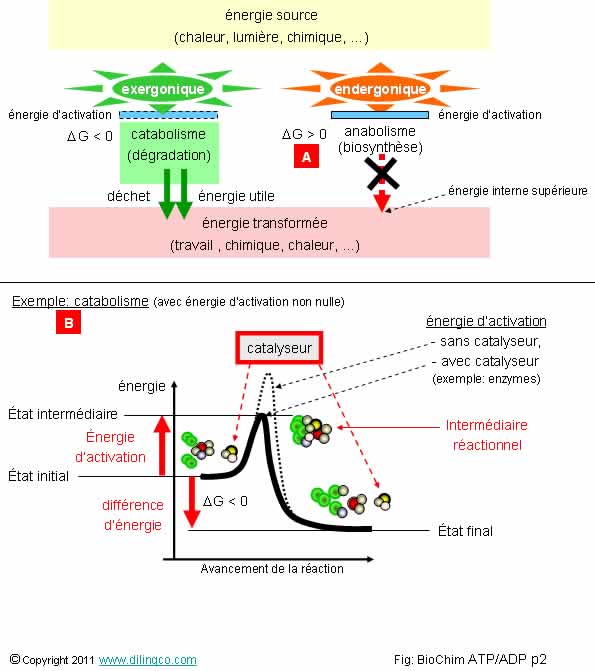
les quatre affirmations exactes :
1- [A] :
Variation positive de l’enthalpie libre : l’énergie des produits est supérieure
à celle des réactifs de départ (il a fallu un apport d’énergie)
2- Une
dégradation cellulaire (catabolisme), dégage de l’énergie
3- Si
l’énergie d’activation est suffisante et si la variation d’enthalpie libre est
négative, la réaction chimique démarre spontanément
4- Les
atomes d’un catalyseur se combinent à ceux des réactifs pour donner les
produits : le catalyseur est consommé par la réaction
5- Un
catalyseur augmente l’énergie d’activation nécessaire pour lancer une réaction
6- L’état
final d’une réaction exergonique est celui de plus faible énergie
7-
[B] : exemple d’une réaction d’anabolisme
Les affirmations
1, 2, 3 et 6 sont exactes.
Affirmation
5
Non, c’est
l’inverse :
Un catalyseur diminue l’énergie d’activation
nécessaire pour lancer une réaction.
L’intermédiaire
réactionnel éventuel se disloque et n’est plus présent en fin de réaction et
dans la formule chimique.
Affirmation
7
Non.
Un
exemple de réaction d’anabolisme
présenterait une énergie finale interne supérieure
à celle de départ.
Une réaction de catabolisme peut nécessiter une
énergie d’activation pour démarrer.
Exemple : une allumette apporte l’énergie d’activation nécessaire à un
feu.
Rappels :
Exergonique
Une
réaction chimique exergonique démarre spontanément.
- Son
enthalpie libre est négative DG < 0,
(Énergie finale plus faible que celle de départ)
- Non réversible,
- Augmente le désordre du système.
Les réactions de catabolisme sont exergoniques.
Endergonique
Une réaction chimique endergonique nécessite un apport d’énergie
pour démarrer.
(Un peu comme une allumette pour mettre le feu)
- Variation d’enthalpie libre DG > 0
- L’ordre du système augmente.
Les réactions d’anabolisme sont endergoniques.
Énergie d’activation / Catalyseur
L’énergie d’activation est l’énergie initiale qui permet aux
molécules d’entrer en collision et rompre les liaisons chimiques existantes.
Page 3.
Réactions couplées
Sélectionner
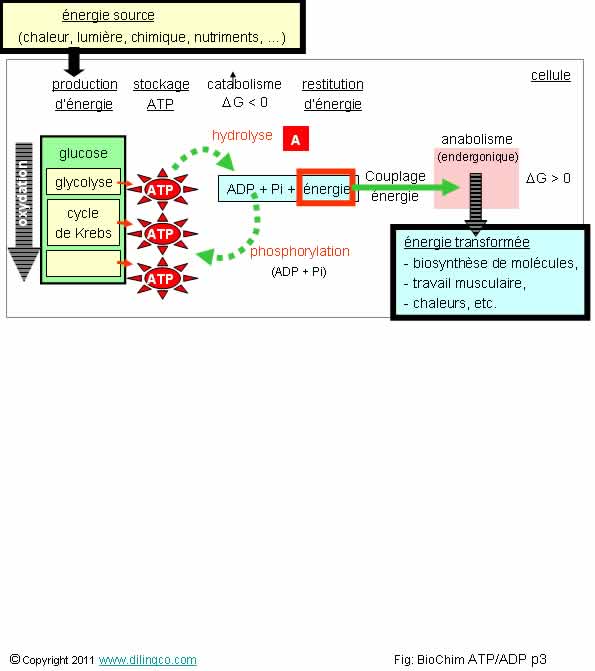
l’affirmation exacte :
1- [A] :
L’arrêt du catabolisme ATP/ADP ne signifie pas l’arrêt des réactions
d’anabolisme
2- [A] :
L’ATP est la molécule des organismes vivants qui fournit, par hydrolyse,
l’énergie aux réactions chimiques d’anabolisme.
3- L’ATP,
adénosine triphosphate, contient moins de groupements phosphate que l’ADP,
adénosine diphosphate
4- La perte
d’un groupement phosphate de la molécule d’ATP (pour donner de l’ADP) consomme
de l’énergie
L’affirmation
2 est exacte.
Affirmation
1
Si.
Un être vivant réalise en permanence des infinités de réactions d’anabolisme.
Dans les
réactions d’anabolisme l’état final est plus organisé que l’état de départ et
représente un gain d’énergie.
Le couplage des réactions d’anabolisme avec des réactions de catabolisme rend
l’ensemble possible.
Conséquence :
L’arrêt du catabolisme ATP/ADP signifie l’arrêt des réactions
d’anabolisme.
… et la mort de l’organisme vivant concerné.
Affirmation
3
Non.
ATP, adénosine
triphosphate = trois groupements
ADP,
adénosine diphosphate = deux groupement
Affirmation
4
Non.
La perte d’un groupement phosphate de la molécule d’ATP, pour donner
de l’ADP et du Pi, accroît l’entropie (le désordre) et libère donc de l’énergie.
Rappels :
Couplage
énergétique
Le
couplage énergétique associe une réaction exergonique qui apporte l’énergie à une
réaction endergonique qui en a besoin pour
se réaliser et atteindre
un niveau final plus ordonné et plus énergétique.
Les deux réactions couplées doivent avoir un intermédiaire commun
qui les solidarise.
Principes
de la thermodynamique
- La
réaction exergonique perd de l’énergie (DH et DG < 0), au profit de la réaction endergonique
qui en a besoin (DH et DG > 0).
- La globalité
« réaction endernomique + réaction exergonique couplée» a une
enthalpie libre résultante négative DG < 0
Biochimie
Les
réactions cellulaires d’anabolisme sont très nombreuses.
Les réactions d’anabolisme sont endergoniques.
Pour se
réaliser, les réactions d’anabolisme sont couplées avec des réactions de
catabolisme exergoniques.
En biochimie cellulaire, le catabolisme de l’ATP en ADP est la réaction
qui fournie l’énergie nécessaire à la réaction d’anabolisme associée.
Une cellule peut consommer plusieurs millions de molécules d’ATP
par seconde.
ATP : molécule adénosine triphosphate
ADP : molécule adénosine diphosphate
Pi :
Phosphate inorganique
Page 4.
Catabolisme. Structures
ATP & ADP
Sélectionner
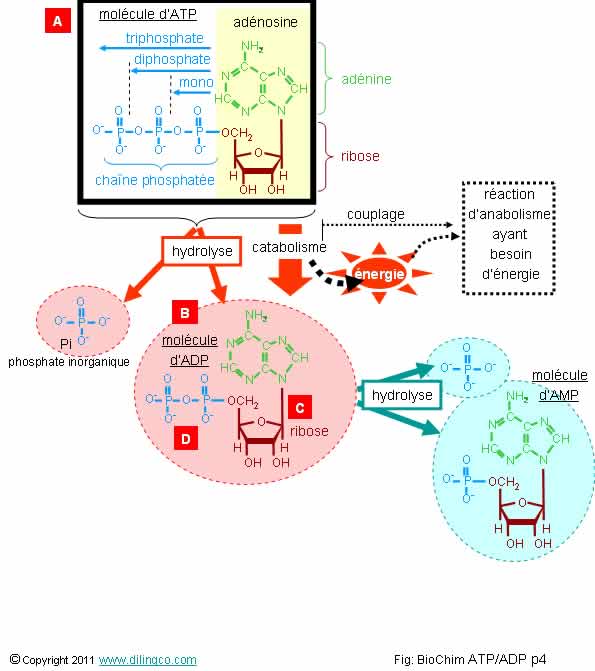
les trois affirmations exactes :
1-
[A] : L’adénosine triphosphate, contient moins de groupements phosphates que
l’adénosine diphosphate
2- [B] :
molécule d’ATP. [C] : groupement adénine
3- La
réaction de catabolisme de l’ATP avec l’eau (hydrolisation), dégage beaucoup
d’énergie (11 à 13 Kcal/mole)
4- La
molécule d’ATP est un nucléotide formé d’une base azotée adénine, d’un ribose,
et de 3 groupements phosphates
5- [D] :
Les charges négatives sur les oxygènes voisins ont une réaction répulsive affaiblissant
la molécule : L’ADP (2 O-) est donc moins stable que l’ATP (3 O-)
6- L’ATP est un transporteur activé de groupements phosphoryles
Les affirmations
3, 4 et 6 sont exactes.
Affirmation
3
Oui.
L’énergie
provient de :
- L’enlèvement du groupement phosphate final qui supprime
des répulsions défavorables entre charges négatives des atomes
d’oxygène voisins,
- La
stabilité du phosphate inorganique
détaché qui établie des liaisons hydrogène avec
l’eau.
Affirmation
4
Oui
Un nucléotide est une molécule organique formée de
trois parties :
- d’une base azotée adénine,
- d’un ribose,
- et de 1 à 3 groupements phosphates.
Affirmation
5
Non.
L’ADP est
plus stable que l’ATP.
ATP
+ H2O -> ADP + Pi + énergie
Energie dégagée
:
- l’ADP
est plus stable (moins de O- répulsif affaiblissant les liaisons
covalentes de la molécule), avec un niveau d’énergie plus bas, que l’ATP (plus
de charges O-),
- l’ion
Pi perd sa charge négative, et donc de l’énergie, lorsque une liaison hydrogène
est créée avec l’eau.
L’AMP,
adénosine monophosphate, est plus stable, moins chargé, que l’ADP.
Le catabolisme, ADP/AMP, dégage aussi beaucoup d’énergie.
ADP
+ H2O -> AMP + Pi + énergie
Affirmation
6
Oui.
Le transfert d’un ion ou d’une molécule à travers une membrane cellulaire est dit actif s’il
nécessite de l’énergie, passif s’il n’utilise pas d’énergie.
Rappels :
ATP : molécule adénosine triphosphate
L’ATP est
une molécule qui fonctionne comme un réservoir à
énergie.
ADP : molécule adénosine diphosphate
Adénosine : adénine lié à un ribose
Pi :
Phosphate inorganique
Hydrolyse : décomposition d’une substance par l’action des ions H3O+
et HO- de l’eau dissociée.
Catabolisme
ATP/ADP
Le
catabolisme de l’ATP (réservoir d’énergie), en ADP fournie beaucoup d’énergie.
L’énergie
provient de :
- L’enlèvement du groupement phosphate final supprime
les répulsions défavorables entre charges négatives des atomes
d’oxygène voisins,
- La
stabilité du phosphate inorganique
détaché qui établie des liaisons hydrogène avec
l’eau.
ATP
+ H2O -> ADP + Pi + énergie
Energie dégagée
:
- l’ADP
est plus stable, avec un niveau d’énergie plus bas et donc une perte d’énergie,
que l’ATP,
- l’ion
Pi perd sa charge négative, et donc de l’énergie, lorsque une liaison hydrogène
est créée avec l’eau.
Catabolisme
ADP/AMP
L’AMP,
adénosine monophosphate, est plus stable que l’ADP.
Le catabolisme, ADP/AMP, dégage aussi beaucoup d’énergie.
ADP
+ H2O -> AMP + Pi + énergie
Page 5
Couplage. Consommation
d’énergie

Sélectionner
l’affirmation exacte :
1-
[A] : La transformation du glucose en glucose 6-phosphate à besoin
d’énergie : c’est une réaction de catabolisme
2- [B] : molécule d’ADP
3- [C] : du glucose au glucose 6P, la molécule à perdu un hydrogène :
le glucose c’est réduit
4- Une réaction chimique endergonique
nécessite un apport d’énergie pour démarrer
L’affirmation
4 est exacte.
Affirmation
1
Non.
La molécule finale est plus complexe que la molécule de départ ; La
réaction a eu besoin d’énergie pour se réaliser : c’est une réaction de
synthèse ; d’anabolisme
Affirmation
3
Non.
Une réduction est un gain d’électron(s).
Une oxydation est une perte d’électron(s).
L’électron
perdu provient souvent de la perte d’un hydrogène
(proton H+ plus un électron e-) :
une molécule qui perd de l’hydrogène, perd un
électron, et donc s’oxyde.
Le glucose
6-phosphate est une oxydation du glucose.
Rappels :
Phosphorylation
Une réaction
de phosphorylation est un ajout d'un ion
phosphate à une molécule cible.
La molécule cible, appelée le substrat, peut être
un sucre, une protéine, un lipide,
ou encore une kinase.
Exemple
de la figure :
Le Pi,
Phosphate inorganique, s’attache au glucose pour former le glucose 6-phosphate.
Hydrolyse
Une hydrolyse est une rupture d’une molécule sous l’effet de l’eau
(à ne pas confondre avec une hydratation qui est un ajout d’eau).
Exemple
de la figure :
Séparation
en Pi et en ADP de la molécule d’ATP sous l’effet de l’eau.
Page 6
Couplage. Fourniture
d’énergie
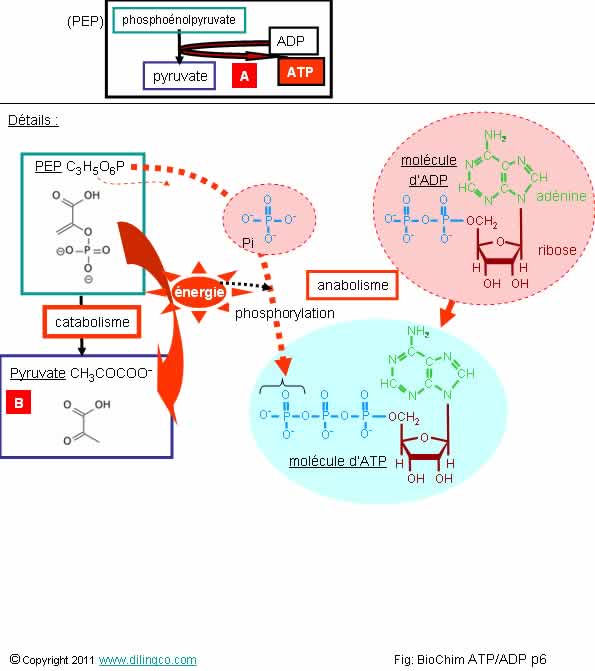
Sélectionner
l’affirmation exacte :
1-
[A] : réaction d’anabolisme du PEP en pyruvate
2-
[B] : L’oxydation du PEP fournit l’énergie nécessaire à la phosphorylation
d’une molécule d’ADP en ATP
3-
[B] : La réduction du PEP fournit l’énergie nécessaire à la
phosphorylation d’une molécule d’ADP en ATP
4-
[B] : il y a phosphorylation du pyruvate
L’affirmation
2 est exacte.
Affirmation
1
Non.
[A] :
réaction de catabolisme du PEP en Pyruvate.
Il y a fourniture et stockage d’énergie dans une molécule d’ATP.
Affirmation
3
Non.
Une réduction est un gain d’électron(s).
Une oxydation est une perte d’électron(s).
L’électron
perdu provient souvent de la perte d’un hydrogène
(proton H+ plus un électron e-) :
une molécule qui perd de l’hydrogène, perd un
électron, et donc s’oxyde.
Le
catabolisme du PEP en anion pyruvate lui fait perdre de l’hydrogène,
Il s’agit
d’une oxydation du PEP.
Rappels :
PEP, Phosphoénolpyruvate
Le PEP a un groupement phosphate dont le potentiel de transfert énergétique est
le plus élevé trouvé chez les vivants :
ΔG°' = -61,9 kJ⋅mol-1
Page 7.
Equilibre et
réversibilité
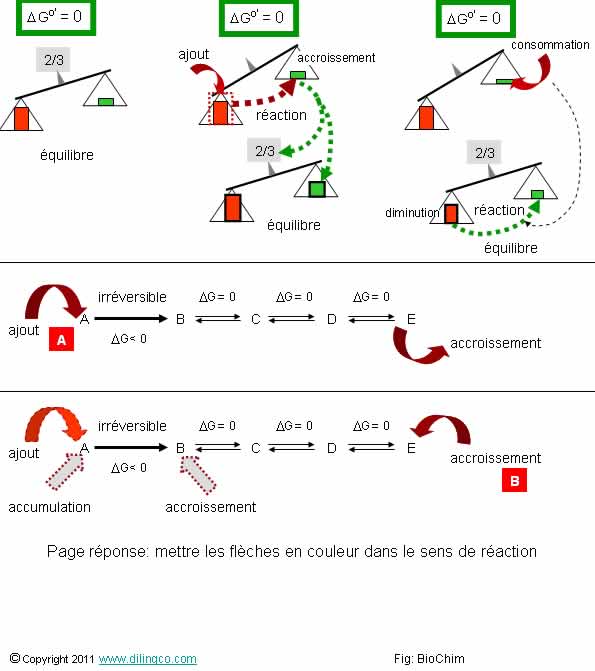
Sélectionner
les deux affirmations exactes :
1- La
valeur de l’entropie libre ne définit pas l’équilibre ou le sens d’une réaction
2- Réaction
réversible : se produit dans le sens réactifs/produits, ou dans le sens inverse,
pour rétablir un rapport de concentration produits/réactifs constant
3- Une
réaction réversible est une réaction éloignée de son état d’équilibre
4- Dans
une réaction équilibrée, la concentration des produits est égale à la
concentration des réactifs
5-
[A] : L’accroissement de A n’entraîne pas l’accroissement de E
6-
[B] : L’accroissement de E provoque l’accroissement de B. L’enthalpie de
la réaction A/B diminue : moins de A sera transformé en B
Les
affirmations 2 et 6 sont exactes.
Affirmation
1
Si.
Rappels : voir chapitre Thermodynamique.
Variation
d’enthalpie libre :
Le système évolue vers son état de plus faible énergie.
Le signe
de variation de l’enthalpie libre détermine le sens de la réaction chimique.
Réactions « réactifs vers produits » :
DG T,p(sys) = DH sys – TDSsys < 0
Réactions « produits vers réactifs » :
DG T,p(sys) = DH sys – TDSsys > 0
Réaction
à l’équilibre :
DG T,p(sys) = 0 = La réaction s’arrête.
Avec :
S : entropie
(mesure du désordre),
H : enthalpie
(variation d’enthalpie => chaleur).
Rappels :
Réversible/irréversible
Deux
types de réactions :
Réactions
réversibles :
- La
réaction est proche de l’équilibre DG=0,
- Des
petites variations de l’environnement peuvent influencer le sens de la réaction
(A -> B ou B -> A)
Réactions
irréversibles :
- L’état
de départ de la réaction est éloigné de l’état final,
- Les
réactifs sont irrémédiablement transformés en produits,
- La
variation d’entropie libre de la réaction est importante.
DG<0 => sens de
la réaction réactifs transformés en produits
Loi de
Le Châtelier
Dans le
cas d’une réaction à l’équilibre, une modification de concentration d’un des éléments provoque une réaction inverse pour rétablir l’équilibre
La figure
illustre la loi.
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Énergie. Stockage & restitution

Sélectionner l’affirmation exacte:
1- Les principes de la thermodynamique ne s’appliquent pas à la biochimie
2- ADP : molécule d’adénosine triphosphate
3- [B] : La réaction d’hydrolyse de l’ATP est une réaction d’hydratation
4- [A] : Catabolisme : processus division moléculaire exothermique
L’affirmation 4 est exacte.
Affirmation 1
Si.
Les principes de la thermodynamique s’appliquent à la biochimie
Affirmation 2
Non.
ADP : molécule d’adénosine diphosphate
ATP : adénosine triphosphate
L’ATP est la molécule de stockage d’énergie de notre organisme.
L’hydrolyse de l’ATP est très exergonique.
L’énergie restituée est utilisée, par couplage,
par des réactions endergoniques, qui ont besoin d’énergie, pour se réaliser.
Affirmation 3
Non.
[B] :
Hydrolyse, division de la molécule d’ATP, par des enzymes ATPases.
Ne pas confondre
Hydratation
Addition de l’eau à une molécule.
Hydrolyse
Définition par défaut : Coupure d’une molécule sous l’action de l’eau.
Mais, il existe aussi des hydrolyses chimiques (en milieu acide), et enzymatiques.
Exemple : hydrolyse de l’ATP par des enzymes ATPases.
Déshydratation (ou condensation)
Perte d’une molécule d’eau.
Solvatation (dispersion)
La solvatation résulte de :
- l’interaction électrostatique de l’eau avec des solutés ionisables,
- l’interaction dipôle-dipôle ou liaisons hydrogènes dans le cas de solutés non ionisables mais polarisés.
Affirmation 4
Oui.
[A] : Catabolisme : processus division moléculaire exothermique.
Exemples :
- catabolisme du glucose en molécules d’ATP, de CO2, d’H2O,
- catabolisme de la molécule d’ATP en molécule d’ADP
(Catabolisme : perte d’un PI, phosphate inorganique ; voir pages ci-après)
Rappels :
Métabolisme
Le métabolisme est l’ensemble des processus des transformations moléculaires et énergétiques qui se déroulent dans les cellules ou l’organisme considéré.
Les deux composantes du métabolisme :
- Le catabolisme, réactions de dégradation et de production d’énergie,
- L’anabolisme, réactions de synthèse de la cellule.
Catabolisme
Le catabolisme est l’ensemble des réactions chimiques de dégradations moléculaires.
Les réactions de catabolisme sont :
- des oxydations chimiques (ou deshydrogénations),
- exoénergétiques (productrices d’énergie).
Anabolisme
L’anabolisme est l’ensemble des réactions chimiques de synthèses qui permettent à une cellule de synthétiser les éléments indispensables à sa vie ou à sa fonction.
Anabolisme = biosynthèse
Les réactions d’anabolisme sont :
- des réductions chimiques,
- endoénergétiques (qui consomment de l’énergie).
Biomolécules
(Molécules biologiques)
Molécules organiques qui composent les cellules du vivant.
Suivant la complexité, la masse moléculaire, on classe les biomolécules en :
- Métabolites (petites molécules),
- Macromolécules, molécules de grandes tailles et de masse moléculaire élevée.
Page 2.
Exergonique. Endergonique. Catalyse

Sélectionner les quatre affirmations exactes :
1- [A] : Variation positive de l’enthalpie libre : l’énergie des produits est supérieure à celle des réactifs de départ (il a fallu un apport d’énergie)
2- Une dégradation cellulaire (catabolisme), dégage de l’énergie
3- Si l’énergie d’activation est suffisante et si la variation d’enthalpie libre est négative, la réaction chimique démarre spontanément
4- Les atomes d’un catalyseur se combinent à ceux des réactifs pour donner les produits : le catalyseur est consommé par la réaction
5- Un catalyseur augmente l’énergie d’activation nécessaire pour lancer une réaction
6- L’état final d’une réaction exergonique est celui de plus faible énergie
7- [B] : exemple d’une réaction d’anabolisme
Les affirmations 1, 2, 3 et 6 sont exactes.
Affirmation 5
Non, c’est l’inverse :
Un catalyseur diminue l’énergie d’activation nécessaire pour lancer une réaction.
L’intermédiaire réactionnel éventuel se disloque et n’est plus présent en fin de réaction et dans la formule chimique.
Affirmation 7
Non.
Un
exemple de réaction d’anabolisme
présenterait une énergie finale interne supérieure
à celle de départ.
Une réaction de catabolisme peut nécessiter une
énergie d’activation pour démarrer.
Exemple : une allumette apporte l’énergie d’activation nécessaire à un
feu.
Rappels :
Exergonique
Une réaction chimique exergonique démarre spontanément.
- Son enthalpie libre est négative DG < 0,
(Énergie finale plus faible que celle de départ)
- Non réversible,
- Augmente le désordre du système.
Les réactions de catabolisme sont exergoniques.
Endergonique
Une réaction chimique endergonique nécessite un apport d’énergie pour démarrer.
(Un peu comme une allumette pour mettre le feu)
- Variation d’enthalpie libre DG > 0
- L’ordre du système augmente.
Les réactions d’anabolisme sont endergoniques.
Énergie d’activation / Catalyseur
L’énergie d’activation est l’énergie initiale qui permet aux molécules d’entrer en collision et rompre les liaisons chimiques existantes.
Page 3.
Réactions couplées

Sélectionner l’affirmation exacte :
1- [A] : L’arrêt du catabolisme ATP/ADP ne signifie pas l’arrêt des réactions d’anabolisme
2- [A] : L’ATP est la molécule des organismes vivants qui fournit, par hydrolyse, l’énergie aux réactions chimiques d’anabolisme.
3- L’ATP, adénosine triphosphate, contient moins de groupements phosphate que l’ADP, adénosine diphosphate
4- La perte d’un groupement phosphate de la molécule d’ATP (pour donner de l’ADP) consomme de l’énergie
L’affirmation 2 est exacte.
Affirmation 1
Si.
Un être vivant réalise en permanence des infinités de réactions d’anabolisme.
Dans les
réactions d’anabolisme l’état final est plus organisé que l’état de départ et
représente un gain d’énergie.
Le couplage des réactions d’anabolisme avec des réactions de catabolisme rend
l’ensemble possible.
Conséquence :
L’arrêt du catabolisme ATP/ADP signifie l’arrêt des réactions d’anabolisme.
… et la mort de l’organisme vivant concerné.
Affirmation 3
Non.
ATP, adénosine triphosphate = trois groupements
ADP, adénosine diphosphate = deux groupement
Affirmation 4
Non.
La perte d’un groupement phosphate de la molécule d’ATP, pour donner de l’ADP et du Pi, accroît l’entropie (le désordre) et libère donc de l’énergie.
Rappels :
Couplage énergétique
Le couplage énergétique associe une réaction exergonique qui apporte l’énergie à une réaction endergonique qui en a besoin pour se réaliser et atteindre un niveau final plus ordonné et plus énergétique.
Les deux réactions couplées doivent avoir un intermédiaire commun qui les solidarise.
Principes de la thermodynamique
- La
réaction exergonique perd de l’énergie (DH et DG < 0), au profit de la réaction endergonique
qui en a besoin (DH et DG > 0).
- La globalité
« réaction endernomique + réaction exergonique couplée» a une
enthalpie libre résultante négative DG < 0
Biochimie
Les réactions cellulaires d’anabolisme sont très nombreuses.
Les réactions d’anabolisme sont endergoniques.
Pour se réaliser, les réactions d’anabolisme sont couplées avec des réactions de catabolisme exergoniques.
En biochimie cellulaire, le catabolisme de l’ATP en ADP est la réaction qui fournie l’énergie nécessaire à la réaction d’anabolisme associée.
Une cellule peut consommer plusieurs millions de molécules d’ATP par seconde.
ATP : molécule adénosine triphosphate
ADP : molécule adénosine diphosphate
Pi : Phosphate inorganique
Page 4.
Catabolisme. Structures ATP & ADP

Sélectionner les trois affirmations exactes :
1- [A] : L’adénosine triphosphate, contient moins de groupements phosphates que l’adénosine diphosphate
2- [B] : molécule d’ATP. [C] : groupement adénine
3- La réaction de catabolisme de l’ATP avec l’eau (hydrolisation), dégage beaucoup d’énergie (11 à 13 Kcal/mole)
4- La molécule d’ATP est un nucléotide formé d’une base azotée adénine, d’un ribose, et de 3 groupements phosphates
5- [D] :
Les charges négatives sur les oxygènes voisins ont une réaction répulsive affaiblissant
la molécule : L’ADP (2 O-) est donc moins stable que l’ATP (3 O-)
6- L’ATP est un transporteur activé de groupements phosphoryles
Les affirmations 3, 4 et 6 sont exactes.
Affirmation 3
Oui.
L’énergie
provient de :
- L’enlèvement du groupement phosphate final qui supprime
des répulsions défavorables entre charges négatives des atomes
d’oxygène voisins,
- La stabilité du phosphate inorganique détaché qui établie des liaisons hydrogène avec l’eau.
Affirmation 4
Oui
Un nucléotide est une molécule organique formée de trois parties :
- d’une base azotée adénine,
- d’un ribose,
- et de 1 à 3 groupements phosphates.
Affirmation 5
Non.
L’ADP est plus stable que l’ATP.
ATP + H2O -> ADP + Pi + énergie
Energie dégagée :
- l’ADP est plus stable (moins de O- répulsif affaiblissant les liaisons covalentes de la molécule), avec un niveau d’énergie plus bas, que l’ATP (plus de charges O-),
- l’ion Pi perd sa charge négative, et donc de l’énergie, lorsque une liaison hydrogène est créée avec l’eau.
L’AMP,
adénosine monophosphate, est plus stable, moins chargé, que l’ADP.
Le catabolisme, ADP/AMP, dégage aussi beaucoup d’énergie.
ADP + H2O -> AMP + Pi + énergie
Affirmation 6
Oui.
Le transfert d’un ion ou d’une molécule à travers une membrane cellulaire est dit actif s’il nécessite de l’énergie, passif s’il n’utilise pas d’énergie.
Rappels :
ATP : molécule adénosine triphosphate
L’ATP est une molécule qui fonctionne comme un réservoir à énergie.
ADP : molécule adénosine diphosphate
Adénosine : adénine lié à un ribose
Pi : Phosphate inorganique
Hydrolyse : décomposition d’une substance par l’action des ions H3O+ et HO- de l’eau dissociée.
Catabolisme ATP/ADP
Le catabolisme de l’ATP (réservoir d’énergie), en ADP fournie beaucoup d’énergie.
L’énergie
provient de :
- L’enlèvement du groupement phosphate final supprime
les répulsions défavorables entre charges négatives des atomes
d’oxygène voisins,
- La stabilité du phosphate inorganique détaché qui établie des liaisons hydrogène avec l’eau.
ATP + H2O -> ADP + Pi + énergie
Energie dégagée :
- l’ADP est plus stable, avec un niveau d’énergie plus bas et donc une perte d’énergie, que l’ATP,
- l’ion Pi perd sa charge négative, et donc de l’énergie, lorsque une liaison hydrogène est créée avec l’eau.
Catabolisme ADP/AMP
L’AMP,
adénosine monophosphate, est plus stable que l’ADP.
Le catabolisme, ADP/AMP, dégage aussi beaucoup d’énergie.
ADP + H2O -> AMP + Pi + énergie
Page 5
Couplage. Consommation d’énergie

Sélectionner l’affirmation exacte :
1-
[A] : La transformation du glucose en glucose 6-phosphate à besoin
d’énergie : c’est une réaction de catabolisme
2- [B] : molécule d’ADP
3- [C] : du glucose au glucose 6P, la molécule à perdu un hydrogène :
le glucose c’est réduit
4- Une réaction chimique endergonique nécessite un apport d’énergie pour démarrer
L’affirmation 4 est exacte.
Affirmation 1
Non.
La molécule finale est plus complexe que la molécule de départ ; La
réaction a eu besoin d’énergie pour se réaliser : c’est une réaction de
synthèse ; d’anabolisme
Affirmation 3
Non.
Une réduction est un gain d’électron(s).
Une oxydation est une perte d’électron(s).
L’électron perdu provient souvent de la perte d’un hydrogène (proton H+ plus un électron e-) : une molécule qui perd de l’hydrogène, perd un électron, et donc s’oxyde.
Le glucose 6-phosphate est une oxydation du glucose.
Rappels :
Phosphorylation
Une réaction de phosphorylation est un ajout d'un ion phosphate à une molécule cible.
La molécule cible, appelée le substrat, peut être un sucre, une protéine, un lipide, ou encore une kinase.
Exemple de la figure :
Le Pi, Phosphate inorganique, s’attache au glucose pour former le glucose 6-phosphate.
Hydrolyse
Une hydrolyse est une rupture d’une molécule sous l’effet de l’eau (à ne pas confondre avec une hydratation qui est un ajout d’eau).
Exemple de la figure :
Séparation en Pi et en ADP de la molécule d’ATP sous l’effet de l’eau.
Page 6
Couplage. Fourniture d’énergie

Sélectionner l’affirmation exacte :
1- [A] : réaction d’anabolisme du PEP en pyruvate
2- [B] : L’oxydation du PEP fournit l’énergie nécessaire à la phosphorylation d’une molécule d’ADP en ATP
3- [B] : La réduction du PEP fournit l’énergie nécessaire à la phosphorylation d’une molécule d’ADP en ATP
4-
[B] : il y a phosphorylation du pyruvate
L’affirmation 2 est exacte.
Affirmation 1
Non.
[A] :
réaction de catabolisme du PEP en Pyruvate.
Il y a fourniture et stockage d’énergie dans une molécule d’ATP.
Affirmation 3
Non.
Une réduction est un gain d’électron(s).
Une oxydation est une perte d’électron(s).
L’électron perdu provient souvent de la perte d’un hydrogène (proton H+ plus un électron e-) : une molécule qui perd de l’hydrogène, perd un électron, et donc s’oxyde.
Le catabolisme du PEP en anion pyruvate lui fait perdre de l’hydrogène,
Il s’agit
d’une oxydation du PEP.
Rappels :
PEP, Phosphoénolpyruvate
Le PEP a un groupement phosphate dont le potentiel de transfert énergétique est
le plus élevé trouvé chez les vivants :
ΔG°' = -61,9 kJ⋅mol-1
Page 7.
Equilibre et réversibilité

Sélectionner les deux affirmations exactes :
1- La valeur de l’entropie libre ne définit pas l’équilibre ou le sens d’une réaction
2- Réaction réversible : se produit dans le sens réactifs/produits, ou dans le sens inverse, pour rétablir un rapport de concentration produits/réactifs constant
3- Une réaction réversible est une réaction éloignée de son état d’équilibre
4- Dans une réaction équilibrée, la concentration des produits est égale à la concentration des réactifs
5- [A] : L’accroissement de A n’entraîne pas l’accroissement de E
6- [B] : L’accroissement de E provoque l’accroissement de B. L’enthalpie de la réaction A/B diminue : moins de A sera transformé en B
Les affirmations 2 et 6 sont exactes.
Affirmation 1
Si.
Rappels : voir chapitre Thermodynamique.
Variation d’enthalpie libre :
Le système évolue vers son état de plus faible énergie.
Le signe de variation de l’enthalpie libre détermine le sens de la réaction chimique.
Réactions « réactifs vers produits » :
DG T,p(sys) = DH sys – TDSsys < 0
Réactions « produits vers réactifs » :
DG T,p(sys) = DH sys – TDSsys > 0
Réaction
à l’équilibre :
DG T,p(sys) = 0 = La réaction s’arrête.
Avec :
S : entropie (mesure du désordre),
H : enthalpie (variation d’enthalpie => chaleur).
Rappels :
Réversible/irréversible
Deux types de réactions :
Réactions réversibles :
- La réaction est proche de l’équilibre DG=0,
- Des petites variations de l’environnement peuvent influencer le sens de la réaction (A -> B ou B -> A)
Réactions irréversibles :
- L’état de départ de la réaction est éloigné de l’état final,
- Les réactifs sont irrémédiablement transformés en produits,
- La variation d’entropie libre de la réaction est importante.
DG<0 => sens de la réaction réactifs transformés en produits
Loi de Le Châtelier
Dans le cas d’une réaction à l’équilibre, une modification de concentration d’un des éléments provoque une réaction inverse pour rétablir l’équilibre
La figure illustre la loi.