Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page
1.
Eléments de bioénergétique

Sélectionner
les trois affirmations exactes :
1- [A] :
anabolisme, dégradation moléculaire
2-
L’entropie finale d’anabolisme est plus petite que l’entropie initiale :
il faut de l’énergie pour créer de l’ordre et aller contre la tendance vers le désordre
3- [B] :
l’hydrolyse provoque l’éclatement du composé initial. C’est donc un catabolisme
et il y a création d’énergie
4- [C] :
la condensation provoque la synthèse en produit « A-B » plus
structuré que les réactifs initiaux => la réaction produit de l’énergie
5- Une
oxydation est une perte d’électrons
6- Le pH,
potentiel Hydrogène du milieu, n’a pas d’impact sur les réactions enzymatiques
Les
affirmations 2, 3 et 5 sont exactes.
Affirmation
1
Non.
Catabolisme
Les
macromolécules, glucides, lipides, protéines,
sont oxydées en CO2 et H2O.
Affirmation
4
Non.
La
condensation est une synthèse, et donc un anabolisme.
Un apport d’énergie est nécessaire pour une réaction d’anabolisme.
Affirmation
6
Si.
Exemple :
Certaines
enzymes agissent dans l’estomac, au pH acide proche de 2, et sont inactivées
dans l’intestin au pH basique proche de 8.
Rappels :
Catabolisme/anabolisme
Les
réactions de catabolisme sont exergoniques.
Elles
peuvent, par couplage énergétique, fournir de l’énergie pour les réactions de
synthèse, ou d’autre travaux cellulaires (exemple : travail musculaire),
qui sont endergoniques.
Hydrolyse/Condensation
Les
réactions d’hydrolyse et de condensation sont des réactions opposées.
Les
réactions de condensation sont endergoniques
(besoin d’énergie) et thermodynamiquement défavorables.
Les
réactions de biosynthèse sont très souvent des
réactions de condensation.
Transporteurs
/réduction/oxydation
Transporteurs :
NAD+, NADP+, FAD, ATP.
Ces
coenzymes sont appelées transporteurs par leur rôle dans l’acheminement
d’électrons/d’énergie d’une réaction à l’autre.
Les
réactions de catabolisme fournissent des électrons par réduction/hydrolyse des transporteurs.
Les
transporteurs sont à leur tour oxydés (perte
d’électrons), pour fournir de l’énergie ; énergie stockée par synthèse d’ATP.
Les molécules d’ATP sont par la suite hydrolysées pour restituer l’énergie
emmagasinée.
Page 2.
Hydrolyse &
Condensation

Sélectionner
les trois affirmations exactes :
1-
[A] : l’hydrolyse provoque l’éclatement du composé initial. C’est donc un
catabolisme et il y a création d’énergie
2-
[B] : la condensation provoque la synthèse en produit « A-B » plus
structuré que les réactifs initiaux => la réaction produit de l’énergie
3- Le
saccharose (sucre de table) est formé par la condensation d’une molécule de
glucose et d’une molécule de fructose (inverse de la réaction [C])
4-
[C] : L’hydrolyse du saccharose donne du glucose et du fructose ;
molécules isomères : même formule chimique mais structures différentes
5- L’hydrolyse
d’une molécule correspond à l’addition d’eau à cette molécule
6-
[D] : l’ion hydrure est formé d’un proton et d’un électron
7- ion hydroxyde
est un cation. La charge négative est portée par l’hydrogène
Les affirmations
1, 3 et 4 sont exactes.
Affirmation
2
Non.
Les condensations sont des réactions de synthèse et
sont toujours thermodynamiquement défavorables.
Dans
l’organisme, les réactions d’anabolisme sont couplées
avec des réactions de catabolisme qui fournissent l’énergie
nécessaire à la réaction.
Affirmation
4
Oui.
Un sucre est dit D (pour Droite), quand sur la représentation de
Fischer, avec le carbone le plus oxydé situé en haut, l'hydroxyle porté par le carbone asymétrique
d'indice le plus élevé est écrit à droite.
L'énantiomère
sera L et portera le OH équivalent à gauche,
en conséquence.
Affirmation
5
Non.
Hydrolyse = Coupure d’une molécule sous l’action de l’eau.
Affirmation
6
Non.
D] :
l’ion hydrure est formé d’un proton et
de deux électrons
Rappels :
Hydrolyse/Condensation
Les
réactions d’hydrolyse et de condensation sont des réactions opposées.
-
Hydrolyse = catabolisme,
-
Condensation = anabolisme.
Les
réactions de condensation sont endergoniques
(besoin d’énergie) et thermodynamiquement défavorables.
Les
réactions de biosynthèse sont très souvent des
réactions de condensation.
Exemples d’hydrolyses
et de condensations
Hydrolyse
de l’ATP en ADP :
ATP + 2 H2O → ADP +
Pi + H3O+
Variation
d’enthalpie libre standard : ΔG°' = -30,5 kJ⋅mol-1.
Hydrolyse
de l’ATP en AMP :
ATP + 2 H2O → AMP +
Pi + H3O+
Variation
d’enthalpie libre standard : ΔG°' = -45,6 kJ⋅mol-1.
Synthèse/condensation
de l’ATP :
ADP + Pi
+ H3O+ → ATP + 2 H2O
Variation
d’enthalpie libre standard : ΔG°' = 30,5 kJ⋅mol-1.
Hydrolyse
du saccharose :
C12H22O11+H2O
→ C6H12O6 + C6H12O6
(un fructose et un glucose)
Hydrolyse
d’un ester :
R1-COO-R2
+ H2O → R2-OH (alcool)
+ R1-COOH (acide)
Rappels
2H20
<-> H3O+ + OH-
L’eau se
dissocie naturellement en:
- ion oxonium H3O+,
- ion hydroxyde OH-, anion HO-
(La
notation HO- reflète mieux le fait que la charge négative est portée
par l’oxygène ; O6)
Hydratation
Addition de l’eau à une molécule.
L’hydratation
d’un alcène donne un alcool.
L’acétylène
hydraté donne de l’éthanal :
C2H2
+ H2O ---> CH3-CHO.
Hydrolyse
Coupure d’une molécule sous l’action de l’eau.
L’hydrolyse
d’un ester donne un alcool et un acide
(Voir
exemple ci avant)
L’hydrolyse
d’un amine donne un acide et un dérivé amine.
Déshydratation
Perte d’une molécule d’eau.
La
déshydratation de l’éthanol donne l’éthylène.
CH3CH2OH ---> CH2=CH2 + H2O.
Page 3.
Oxydoréductions
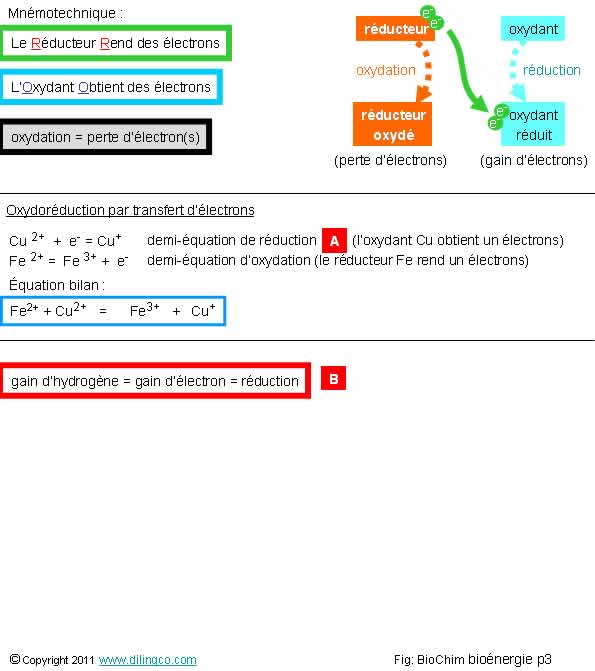
Sélectionner
l’affirmation exacte :
1- Le
réducteur s’oxyde (perte d’électrons) et l’oxydant se réduit (gain d’électrons
2- Une
oxydoréduction est la somme de deux demi réactions. Dans l’exemple, [A] est la demi
réaction d’oxydation
3-
[B] : Un gain d’hydrogène est une oxydation
4- Une
oxydation implique toujours un atome d’oxygène
L’affirmation1
est exacte.
Rappels :
Définitions
anciennes
Une
oxydation est une combinaison avec un ou plusieurs atomes l’oxygène.
Exemples :
2 Hg +
O2 --à Hg2O2
4Fe + 3O2
-à 2 Fe2O3
(rouille)
Une
réduction est un retrait d’un métal de son oxyde
SO2
-à S + O2
Définitions
actualisées
Oxydation
= perte d’électron(s)
Une oxydation est une réaction de catabolisme qui libère/perd
de l’énergie.
Réduction
= gain d’électron(s)
Une réduction est une réaction d’anabolisme qui consomme/gagne
de l’énergie.
Mnémotechnique
Le Réducteur Rend
des électrons
L’Oxydant Obtient
des électrons
Biochimie
Quatre
grands types de transfert d’électrons en biochimie :
- Transfert direct d’électrons, figure [A],
-
Transfert d’électrons par transfert d’hydrogène
L’atome
d’hydrogène étant un proton + un électron ; c’est cet électron qui
est transféré,
-
Transfert d’électrons par transfert d’un ion
hydrure
(Voir
page suivante de ce thème),
ion hydrure = H- = un proton + 2 électrons,
-
Transfert d’électrons par combustion,
combinaison avec l’oxygène
Exemple :
l’oxydation d’un glucide donne un alcool,
R-CH3 +
½ O2 = R – CH2 –OH
Page 4.
Oxydation du glucose
Note :
Cette page de synthèse complète dans le chapitre « Métabolisme
» qui contient les informations générales utiles à la compréhension du
processus présenté.
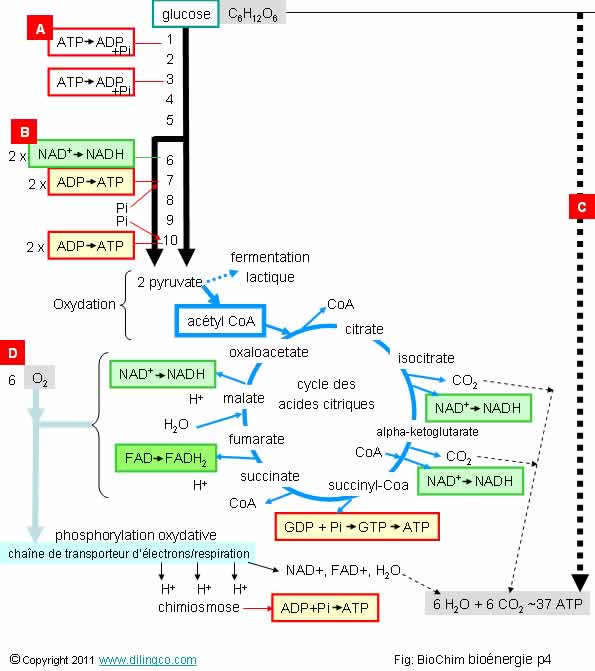
Sélectionner
les deux affirmations exactes :
1- Les 10
premières étapes de transformation du glucose correspondent à la glycolyse et
se réalise en anaérobie
2- [A] :
l’hydrolyse de l’ATP ajoute de l’eau à la molécule d’ATP pour la transformer en
ADP
3- [A] :
l’hydrolyse de l’ATP est un catabolisme et dégage de l’énergie
4- La
transformation du NAD+ en NADH est une hydrolyse du NAD
5-
[B] : Le NAD+ s’est oxydé en NADH
6-
[C] : Le glucose s’est oxydé pour donner 6 CO2
7-
[D] : Les 6 molécules d’oxygène sont oxydées en 6 molécule d’eau
Les
affirmations 1 et 6 sont exactes.
Affirmation
1
Oui.
Anaérobie
= ne nécessite pas d’oxygène
La
glycolyse se réalise dans le glycosol de la cellule
Affirmation
2
Non.
Une hydrolyse correspond à une rupture d’une molécule sous
l’effet de l’eau (à ne pas confondre avec une hydratation qui est un
ajout d’eau).
Ici il
s’agit de la séparation en Pi, Phosphore inorganique, et en ADP, de la molécule
d’ATP sous l’effet de l’eau.
Dans
l’étape 1 de la glycolyse, le Pi s’attache au glucose pour former le glucose
6-phosphate.
Affirmation
5
Non.
[B] :
Le NAD+ s’est réduit en NADH
Gain
d’hydrogène, gain d’électron = réduction
Dans
l’étape 6, l’hydrogène provient du substratCet électron prov
Affirmation
6
Oui.
Perte
d’hydrogènes, donc perte d’électrons = oxydation
Affirmation
7
Non.
[D] :
Les 6 molécules d’oxygène sont réduites
en 6 molécule d’eau
Il y a un gain d’hydrogène, donc d’électrons = réduction
Page 5.
Oxydoréduction / ion
hydrure

Sélectionner
les deux affirmations exactes :
1-
[A] : la réaction 6 de la glycolyse fait perdre deux d’hydrogènes au
substrat => la réaction 6 est une oxydation
2-
[B] : l’enzyme impliquée dans la réaction 6 est une enzyme de classe 1
déshydrogénase : enlèvement d’un hydrogène (proton & électron) =
oxydation du substrat
3- NAD
est l’enzyme de la réaction
4- Le
NAD+ s’est oxydé en NADH
5- [C] :
G3P signifie gaz 3 propane
Les
affirmations 1 et 2 sont exactes.
Affirmation
1
Oui.
Un
aldéhyde est un composé organique dont la chaîne carbonée porte un groupement
carbonyle : –C(=O)-OH
(Donc un
atome d’hydrogène)
Revoir :
chimie organique / groupements
Affirmation
3
Non.
NAD est une coenzyme.
L’enzyme
de la réaction 6 est l’enzyme déshydrogénase EC 1.2.1.12.
Autre exemple
de coenzyme : FAD
Affirmation
4
Non.
NAD+ est l’oxydant
La
coenzyme NAD+ a gagnée un atome d’hydrogène (et un électron), elle s’est réduite en NADH par
gain d’hydrogène et d’électrons
(Oxydation
= perte d’électrons)
Rappels :
Ion
hydrure
[D] :
Transfert d’électrons par transfert d’un ion
hydrure
Ion
hydrure = H- = un proton + 2 électrons,
Définitions
Oxydation
= perte d’électron(s)
Une oxydation est une réaction de catabolisme qui libère/perd
de l’énergie.
Réduction
= gain d’électron(s)
Une réduction est une réaction d’anabolisme qui consomme/gagne
de l’énergie.
Mnémotechnique
Le Réducteur Rend
des électrons
L’Oxydant Obtient
des électrons
Page 6.
Transporteur.
Fermentation lactique
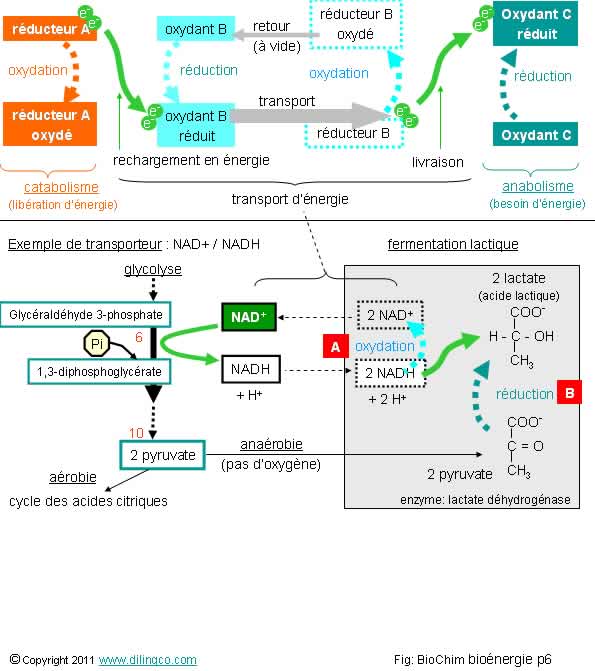
Sélectionner
quatre affirmations exactes :
1- Dans
le cas d’effort physique et de manque d’oxygène, la cellule peut faire une
fermentation lactique pour régénérer du NAD+ et relancer la glycolyse
2- La
glycolyse est constituée d’étapes qui se déroulent dans les mitochondries
3- Le
NADH et le H+ de l’étape 6 de la glycolyse peuvent pénétrer dans les
mitochondries pour y produire de l’ATP
4- En cas
de manque d’oxygène, l’acide pyruvique est converti, par fermentation, en acide
lactique. La fermentation lactique se fait dans le cytoplasme
5-
[A] : le NADH s’oxyde en NAD+
6-
[B] : il y a augmentation d’hydrogènes (donc d’électrons) = réduction du
pyruvate en lactate
Les
affirmations 1, 4, 5 et 6 sont exactes.
Affirmations
2 et 3
Non.
Revoir le
chapitre « Respiration cellulaire ».
Rappels :
Processus
de transport
Le
processus de transport d’énergie (d’électrons) est :
1- Une
réaction de catabolisme libère de l’énergie,
2- Par la suite, une réaction d’anabolisme/synthèse a besoin d’énergie,
- Un
« transporteur » d’énergie sert de
véhicule intermédiaire de transport.
Le
transporteur d’énergie, une coenzyme (exemple : NAD+), se
charge en énergie (en électrons), lors de la
réaction de catabolisme et libère cette énergie, plus tard lors de la réaction d’anabolisme.
Conclusion :
Le
transport d’énergie permet de transporter de l’énergie entre des réactions qui
n’ont pas lieu au même instant.
Fermentations
Deux
types de fermentations (selon l’enzyme présente dans la cellule) :
- Fermentation lactique
Dans
l’organisme, la fermentation lactique est lancée, si le corps a besoin
d’énergie, et si la respiration aérobie ne peut pas se faire. Par manque
d’oxygène suite a un effort physique intense par exemple.
- Fermentation alcoolique
Les
levures et les bactéries sont capables des deux types de fermentation.
Fermentation
lactique
La
fermentation lactique transforme le pyruvate en lactate
(acide lactique).
Lors de la fermentation lactique, l’acide lactique provoque
la baisse du pH qui modifie l’activité des enzymes et entraîne rigidité
musculaire et fatigue.
Le foie, par la néoglucogenèse, transforme le lactate en glucose ; glucose évacué dans le
sang et transformé en énergie par glycolyse et respiration aérobie.
Fermentation
alcoolique
Le
pyruvate est transformé en acétaldéhyde, lui-même transformé en éthanol.
Les
levures et les bactéries sont capables des fermentations alcooliques.
Page 7.
Navette. Glycérol
phosphate

Sélectionnez
les deux affirmations exactes :
1- [A] :
La glycolyse peut se faire sans régénération du NAD+
2- [A] :
régénération du NAD+ : fermentation lactique, en cas d’effort intense, ou en
condition normale par l’enzyme glycérol phosphate déshydrogénase cytosolique
3- [A] :
La régénération du NAD+, réduit par l’étape 6 de la glycolyse, se fait par
phosphorylation oxydative à l’intérieur des mitochondries
4- [B] :
l’oxydation du NADH permet la réduction du dihydroxyacétone phosphate en navette
glycérol phosphate
5-
L’enzyme glycérol phosphate déshydrogénase de la mitochondrie n’a pas d’effet
sur la molécule glycérol phosphate
Les
affirmations 2 et 4 sont exactes.
Affirmation
1
Non.
La glycolyse nécessite du NAD+ disponible dans le cytosol : le NADH produit
par l’étape 6 de la glycolyse doit être réoxydé en NAD+
Affirmation
3
Non :
Le NADH
du cytosol ne peut pas traverser la membrane interne des mitochondries.
Affirmation
5
Si.
Le
glycérol phosphate y perd des atomes d’hydrogène ; il s’oxyde en dihydroxyacétone
phosphate.
Rappels :
Navettes
-
Glycérol phosphate,
- Malatte-aspartate
(voir page suivante)
La
navette glycérol phosphate permet de transférer les
H+ et les électrons du NADH dans
la matrice des mitochondries même si la molécule NADH ne peut pas
traverser les membranes internes mitochondriales.
Page 8.
Navette. Malatte-aspartate
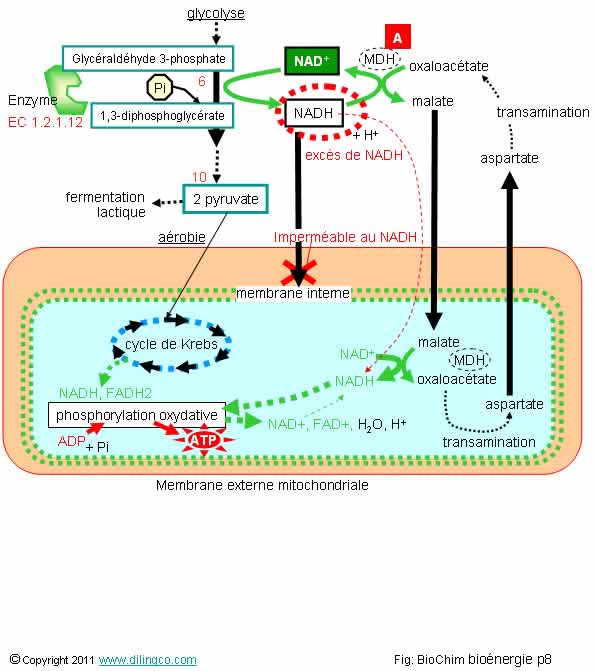
Sélectionner
l’affirmation fausse :
1- [A] :
MDH signifie malate dehydrogenase.
Enzyme présente dans le cytosol et la matrice mitochondriale
2- L’excès
de NADH est régulé par une réaction d’oxydation en NAD+ et une création de malate
3- Un
excès de NADH dans le cytosol entraîne, par l’intermédiaire de la navette malate-aspartate,
une création de NADH et d’ATP dans les mitochondries
4- Le
NADH du cytosol peut traverser la membrane interne des mitochondries
L’affirmation
4 est fausse.
Rappels :
La
navette malatte-aspartate régule les
concentrations de NADH/NAD+ dans le cytosol
Le NADH excédentaire
du cytosol est indirectement transféré en NADH
mitochondrial pour y produire de l’ATP
Étapes
- L’excès
de NADH est oxydé en NAD+
La
réduction associée réduit de l’oxaloacétate en malate,
- Le malate traverse la
membrane interne des mitochondries
- L’oxydation
du malate en oxaloacétate induit une réduction du NAD+
en NADH mitochondrial. Ce NADH, par phosphorylation oxydative,
produira de l’ATP.
Régénération :
- L’oxaloacétate
est, par réaction de transamination, transformé
en aspartate,
- L’aspartate traverse la membrane pour
revenir dans le cytosol.
- Une
deuxième réaction de transamination retransforme l’aspartate en oxaloacétate,
Cet oxaloacétate
régénéré est disponible pour être réduit à nouveau lors d’une régulation, par
oxydation, du NADH en NAD+
Page 9.
Chaîne de transport
d’électrons
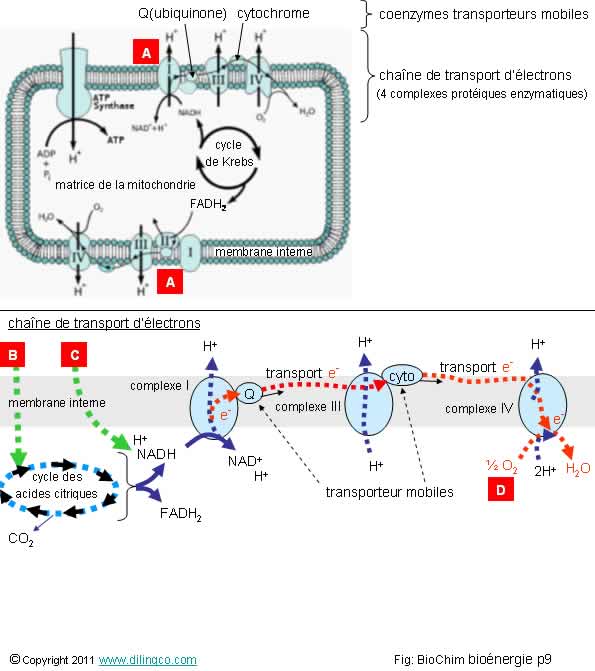
Sélectionner
les trois affirmations exactes :
1- [A] :
La chaîne de respiration est dans la membrane interne mitochondriale
2-
[A] : les complexes I, III et IV expulsent les protons H vers la matrice
mitochondriale
3- [B] :
acétyl coa provenant de l’oxydation du pyruvate (glycolyse), béta oxydation de
l’acyl coa (hélice de Lynen/acide gras), transamination des acides aminés
4-
[C] : NADH de la glycolyse qui traverse la membrane interne mitochondriale
5- [D] :
Par une chaîne de réactions d’oxydoréductions, les électrons d’oxydation du
NADH en NAD+, arrivent à l’accepteur final, l’oxygène moléculaire
Les
affirmations 1, 3 et 5 sont exactes.
Affirmation
2
Non.
[A] :
les complexes I, III et IV expulsent les protons H
vers l’espace inter membranaire.
Affirmation
3
Oui.
L’oxydation
du pyruvate en acétyl CoA se fait dans la mitochondrie avec dégagement d’une
molécule de CO2. L’oxydation du pyruvate entraîne la réaction de
réduction du NAD+ en NADH. Réaction catalysée par une enzyme, la
pyruvate déshydrogénase.
Affirmation
4
Non.
[C] :
La membrane mitochondriale interne est imperméable
au NADH.
Le NADH excédentaire du cytosol est génère indirectement du NADH mitochondrial par la navette Malatte-aspartate.
La chaîne
de respiration oxyde le NADH et le FADH2 en NAD+ et FAD et entraîne la création
d’ATP par phosphorylation de l’ADP.
Affirmation
5
Oui.
Suivant
l’équation :
O2
+ 4 H+ + 4 e- --à 2 H2O
Rappels :
La chaîne
de transport d’électrons (aussi appelée chaîne
respiratoire) est constituée de 4
complexes protéiques :
- complexe I : NADH-coenzyme Q
oxydoréductase,
-
complexe II : succinate-coenzyme Q oxydoréductase,
-
complexe III : coenzyme Q-cytochrome c oxydoréductase,
-
complexe IV : cytochrome c oxydase.
Le coenzyme Q (ubiquinone) et le cytochrome c sont des transporteurs mobiles
d’électrons.
Page 10.
L’oxygène dans la cellule.
RLO
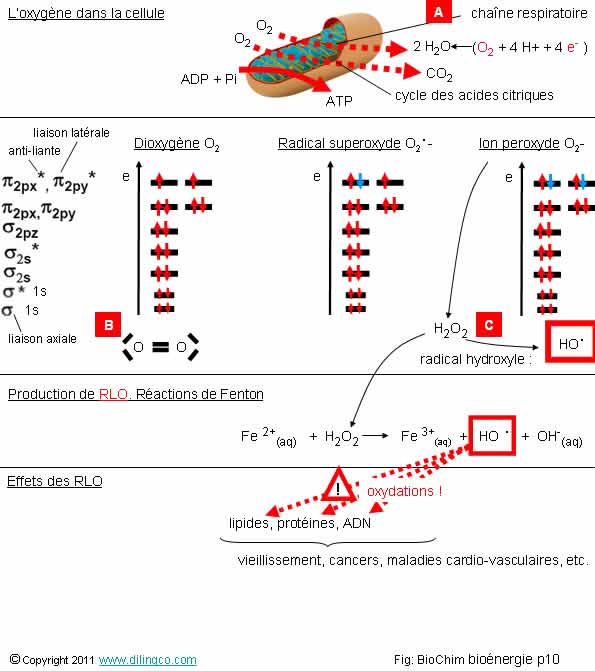
Sélectionner
l’affirmation exacte :
1-
[A] : dans les cellules, la réduction de l’oxygène se fait dans le cycle
de Krebs des mitochondries
2-
[A] : réduction de l’oxygène par fermentation lactique
3-
[B] : représentation de Lewis du dioxygène : une triple liaison entre
les deux atomes d’oxygène
4-
[C] : le radical hydroxyle, fission de la liaison instable O-O de l’eau
oxygénée H2O2, contient un électron libre. Le radical hydroxyle est très
réactif
L’affirmation
4 est exacte.
Affirmation
1 :
Non.
[A] :
la réduction de l’oxygène se fait en fin de chaîne respiratoire, dans les
membranes internes des mitochondries.
L’équation de la réaction de réduction est :
O2
+ 4 H+ + 4 e- --à 2 H2O
Affirmation
2
Non.
La fermentation lactique est une réaction en anaérobie qui se fait
dans le cytoplasme.
Le
pyruvate est réduit en lactate.
En
condition d’efforts intenses et de manque
d’oxygène, la réaction couplée oxyde le NADH et redonne du NAD+
nécessaire à la poursuite de la glycolyse.
Affirmation
4
Oui.
Radical (souvent
appelé « Radical libre ») :
-
structure chimique avec un, ou des, électron(s) célibataire(s) sur une des
couches externes,
- se note
avec un point (exemple : HO.),
- peut être chargé (exemple : ion superoxyde
O2.- )
ou non chargé (exemple : monoxyde d’azote NO)
- sont
instables, réagissent rapidement.
Rappels :
RLO : Radical
Libre de l’Oxygène
Radical
libre :
atome ou molécule dont au moins une orbitale externe contient un électron libre = très instable.
Orbitale
moléculaires :
revoir le chapitre « Chimie – Molécule ».
Oxygène
& RLO dans la cellule
Normalement, l’oxygène est entièrement réduit en eau dans les
mitochondries [A].
L’équation
de la réaction de réduction est :
O2
+ 4 H+ + 4 e- --à 2 H2O
(Revoir
la page « chaîne respiratoire »).
Des
niveaux de réduction peuvent donner des radicaux superoxydes ou des ions
peroxydes.
Par
addition d’un proton H+, les ions peroxydes donnent de l’eau
oxygénée H2O2 .
L’eau
oxygénée, à liaison O-O instable, est à l’origine des radicaux hydroxyles HO. .
L’apport d’énergie nécessaire pour briser la liaison et produire
des radicaux hydroxyles peut être la température, les rayons ionisants, ou la
captation d’un électron par un ion métallique, Fe, Cu, (Réaction de
Fenton).
Effets
des RLO
Les radicaux hydroxyles HO. sont très réactifs.
Les radicaux hydroxyle sont capables d’oxyder les biomolécules :
-
ADN : mort cellulaire, mutations carcinogènes,
- dépôts
lipidiques peroxydés dans les vaisseaux et tissus, dérivés carcinogènes,
-
dérèglements des signaux protéiniques de prolifération ou de défense,
inhibitions enzymatiques, dépôts (fibroses et amyloïdoses).
Le stress
oxydant est donc responsable du vieillissement, de cancers, de maladies
cardio-vasculaires, de diabète, de sclérose latérales amyotrophiques, etc.
Lutte
contre le stress
oxydant
Quelques
moyens de l’organisme pour lutter contre le déséquilibre oxydant de
l’apparition de RLO :
-
utilisation d’enzymes (superoxyde dismutase, peroxidase) pour transformer les
radicaux superoxydes en peroxydes d’hydrogènes puis élimination,
-
destruction des RLO par récupération de l’électron radicalaire (par des
molécules glutathion, vitamines C, E, etc.),
- Fixer
les ions métalliques par des protéines pour diminuer les réactions de Fenton.
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Eléments de bioénergétique

Sélectionner les trois affirmations exactes :
1- [A] : anabolisme, dégradation moléculaire
2- L’entropie finale d’anabolisme est plus petite que l’entropie initiale : il faut de l’énergie pour créer de l’ordre et aller contre la tendance vers le désordre
3- [B] : l’hydrolyse provoque l’éclatement du composé initial. C’est donc un catabolisme et il y a création d’énergie
4- [C] : la condensation provoque la synthèse en produit « A-B » plus structuré que les réactifs initiaux => la réaction produit de l’énergie
5- Une oxydation est une perte d’électrons
6- Le pH, potentiel Hydrogène du milieu, n’a pas d’impact sur les réactions enzymatiques
Les affirmations 2, 3 et 5 sont exactes.
Affirmation 1
Non.
Catabolisme
Les macromolécules, glucides, lipides, protéines, sont oxydées en CO2 et H2O.
Affirmation 4
Non.
La
condensation est une synthèse, et donc un anabolisme.
Un apport d’énergie est nécessaire pour une réaction d’anabolisme.
Affirmation 6
Si.
Exemple :
Certaines enzymes agissent dans l’estomac, au pH acide proche de 2, et sont inactivées dans l’intestin au pH basique proche de 8.
Rappels :
Catabolisme/anabolisme
Les réactions de catabolisme sont exergoniques.
Elles peuvent, par couplage énergétique, fournir de l’énergie pour les réactions de synthèse, ou d’autre travaux cellulaires (exemple : travail musculaire), qui sont endergoniques.
Hydrolyse/Condensation
Les réactions d’hydrolyse et de condensation sont des réactions opposées.
Les réactions de condensation sont endergoniques (besoin d’énergie) et thermodynamiquement défavorables.
Les réactions de biosynthèse sont très souvent des réactions de condensation.
Transporteurs /réduction/oxydation
Transporteurs : NAD+, NADP+, FAD, ATP.
Ces coenzymes sont appelées transporteurs par leur rôle dans l’acheminement d’électrons/d’énergie d’une réaction à l’autre.
Les réactions de catabolisme fournissent des électrons par réduction/hydrolyse des transporteurs.
Les transporteurs sont à leur tour oxydés (perte d’électrons), pour fournir de l’énergie ; énergie stockée par synthèse d’ATP.
Les molécules d’ATP sont par la suite hydrolysées pour restituer l’énergie emmagasinée.
Page 2.
Hydrolyse & Condensation

Sélectionner les trois affirmations exactes :
1- [A] : l’hydrolyse provoque l’éclatement du composé initial. C’est donc un catabolisme et il y a création d’énergie
2- [B] : la condensation provoque la synthèse en produit « A-B » plus structuré que les réactifs initiaux => la réaction produit de l’énergie
3- Le saccharose (sucre de table) est formé par la condensation d’une molécule de glucose et d’une molécule de fructose (inverse de la réaction [C])
4- [C] : L’hydrolyse du saccharose donne du glucose et du fructose ; molécules isomères : même formule chimique mais structures différentes
5- L’hydrolyse d’une molécule correspond à l’addition d’eau à cette molécule
6- [D] : l’ion hydrure est formé d’un proton et d’un électron
7- ion hydroxyde est un cation. La charge négative est portée par l’hydrogène
Les affirmations 1, 3 et 4 sont exactes.
Affirmation 2
Non.
Les condensations sont des réactions de synthèse et sont toujours thermodynamiquement défavorables.
Dans l’organisme, les réactions d’anabolisme sont couplées avec des réactions de catabolisme qui fournissent l’énergie nécessaire à la réaction.
Affirmation 4
Oui.
Un sucre est dit D (pour Droite), quand sur la représentation de
Fischer, avec le carbone le plus oxydé situé en haut, l'hydroxyle porté par le carbone asymétrique
d'indice le plus élevé est écrit à droite.
L'énantiomère sera L et portera le OH équivalent à gauche, en conséquence.
Affirmation 5
Non.
Hydrolyse = Coupure d’une molécule sous l’action de l’eau.
Affirmation 6
Non.
D] : l’ion hydrure est formé d’un proton et de deux électrons
Rappels :
Hydrolyse/Condensation
Les réactions d’hydrolyse et de condensation sont des réactions opposées.
- Hydrolyse = catabolisme,
- Condensation = anabolisme.
Les réactions de condensation sont endergoniques (besoin d’énergie) et thermodynamiquement défavorables.
Les réactions de biosynthèse sont très souvent des réactions de condensation.
Exemples d’hydrolyses et de condensations
Hydrolyse de l’ATP en ADP :
ATP + 2 H2O → ADP + Pi + H3O+
Variation d’enthalpie libre standard : ΔG°' = -30,5 kJ⋅mol-1.
Hydrolyse de l’ATP en AMP :
ATP + 2 H2O → AMP + Pi + H3O+
Variation d’enthalpie libre standard : ΔG°' = -45,6 kJ⋅mol-1.
Synthèse/condensation de l’ATP :
ADP + Pi + H3O+ → ATP + 2 H2O
Variation d’enthalpie libre standard : ΔG°' = 30,5 kJ⋅mol-1.
Hydrolyse du saccharose :
C12H22O11+H2O → C6H12O6 + C6H12O6 (un fructose et un glucose)
Hydrolyse d’un ester :
R1-COO-R2 + H2O → R2-OH (alcool) + R1-COOH (acide)
Rappels
2H20 <-> H3O+ + OH-
L’eau se dissocie naturellement en:
- ion oxonium H3O+,
- ion hydroxyde OH-, anion HO-
(La notation HO- reflète mieux le fait que la charge négative est portée par l’oxygène ; O6)
Hydratation
Addition de l’eau à une molécule.
L’hydratation d’un alcène donne un alcool.
L’acétylène hydraté donne de l’éthanal :
C2H2 + H2O ---> CH3-CHO.
Hydrolyse
Coupure d’une molécule sous l’action de l’eau.
L’hydrolyse d’un ester donne un alcool et un acide
(Voir exemple ci avant)
L’hydrolyse d’un amine donne un acide et un dérivé amine.
Déshydratation
Perte d’une molécule d’eau.
La
déshydratation de l’éthanol donne l’éthylène.
CH3CH2OH ---> CH2=CH2 + H2O.
Page 3.
Oxydoréductions

Sélectionner l’affirmation exacte :
1- Le réducteur s’oxyde (perte d’électrons) et l’oxydant se réduit (gain d’électrons
2- Une oxydoréduction est la somme de deux demi réactions. Dans l’exemple, [A] est la demi réaction d’oxydation
3- [B] : Un gain d’hydrogène est une oxydation
4- Une oxydation implique toujours un atome d’oxygène
L’affirmation1 est exacte.
Rappels :
Définitions anciennes
Une oxydation est une combinaison avec un ou plusieurs atomes l’oxygène.
Exemples :
2 Hg + O2 --à Hg2O2
4Fe + 3O2 -à 2 Fe2O3 (rouille)
Une réduction est un retrait d’un métal de son oxyde
SO2 -à S + O2
Définitions actualisées
Oxydation = perte d’électron(s)
Une oxydation est une réaction de catabolisme qui libère/perd de l’énergie.
Réduction = gain d’électron(s)
Une réduction est une réaction d’anabolisme qui consomme/gagne de l’énergie.
Mnémotechnique
Le Réducteur Rend des électrons
L’Oxydant Obtient des électrons
Biochimie
Quatre grands types de transfert d’électrons en biochimie :
- Transfert direct d’électrons, figure [A],
- Transfert d’électrons par transfert d’hydrogène
L’atome d’hydrogène étant un proton + un électron ; c’est cet électron qui est transféré,
- Transfert d’électrons par transfert d’un ion hydrure
(Voir
page suivante de ce thème),
ion hydrure = H- = un proton + 2 électrons,
- Transfert d’électrons par combustion, combinaison avec l’oxygène
Exemple : l’oxydation d’un glucide donne un alcool,
R-CH3 + ½ O2 = R – CH2 –OH
Page 4.
Oxydation du glucose
Note :
Cette page de synthèse complète dans le chapitre « Métabolisme » qui contient les informations générales utiles à la compréhension du processus présenté.

Sélectionner les deux affirmations exactes :
1- Les 10 premières étapes de transformation du glucose correspondent à la glycolyse et se réalise en anaérobie
2- [A] : l’hydrolyse de l’ATP ajoute de l’eau à la molécule d’ATP pour la transformer en ADP
3- [A] : l’hydrolyse de l’ATP est un catabolisme et dégage de l’énergie
4- La transformation du NAD+ en NADH est une hydrolyse du NAD
5- [B] : Le NAD+ s’est oxydé en NADH
6- [C] : Le glucose s’est oxydé pour donner 6 CO2
7- [D] : Les 6 molécules d’oxygène sont oxydées en 6 molécule d’eau
Les affirmations 1 et 6 sont exactes.
Affirmation 1
Oui.
Anaérobie = ne nécessite pas d’oxygène
La glycolyse se réalise dans le glycosol de la cellule
Affirmation 2
Non.
Une hydrolyse correspond à une rupture d’une molécule sous l’effet de l’eau (à ne pas confondre avec une hydratation qui est un ajout d’eau).
Ici il s’agit de la séparation en Pi, Phosphore inorganique, et en ADP, de la molécule d’ATP sous l’effet de l’eau.
Dans l’étape 1 de la glycolyse, le Pi s’attache au glucose pour former le glucose 6-phosphate.
Affirmation 5
Non.
[B] : Le NAD+ s’est réduit en NADH
Gain d’hydrogène, gain d’électron = réduction
Dans l’étape 6, l’hydrogène provient du substratCet électron prov
Affirmation 6
Oui.
Perte d’hydrogènes, donc perte d’électrons = oxydation
Affirmation 7
Non.
[D] : Les 6 molécules d’oxygène sont réduites en 6 molécule d’eau
Il y a un gain d’hydrogène, donc d’électrons = réduction
Page 5.
Oxydoréduction / ion hydrure

Sélectionner les deux affirmations exactes :
1- [A] : la réaction 6 de la glycolyse fait perdre deux d’hydrogènes au substrat => la réaction 6 est une oxydation
2- [B] : l’enzyme impliquée dans la réaction 6 est une enzyme de classe 1 déshydrogénase : enlèvement d’un hydrogène (proton & électron) = oxydation du substrat
3- NAD est l’enzyme de la réaction
4- Le NAD+ s’est oxydé en NADH
5- [C] : G3P signifie gaz 3 propane
Les affirmations 1 et 2 sont exactes.
Affirmation 1
Oui.
Un aldéhyde est un composé organique dont la chaîne carbonée porte un groupement carbonyle : –C(=O)-OH
(Donc un atome d’hydrogène)
Revoir : chimie organique / groupements
Affirmation 3
Non.
NAD est une coenzyme.
L’enzyme de la réaction 6 est l’enzyme déshydrogénase EC 1.2.1.12.
Autre exemple de coenzyme : FAD
Affirmation 4
Non.
NAD+ est l’oxydant
La coenzyme NAD+ a gagnée un atome d’hydrogène (et un électron), elle s’est réduite en NADH par gain d’hydrogène et d’électrons
(Oxydation = perte d’électrons)
Rappels :
Ion hydrure
[D] : Transfert d’électrons par transfert d’un ion hydrure
Ion hydrure = H- = un proton + 2 électrons,
Définitions
Oxydation = perte d’électron(s)
Une oxydation est une réaction de catabolisme qui libère/perd de l’énergie.
Réduction = gain d’électron(s)
Une réduction est une réaction d’anabolisme qui consomme/gagne de l’énergie.
Mnémotechnique
Le Réducteur Rend des électrons
L’Oxydant Obtient des électrons
Page 6.
Transporteur. Fermentation lactique

Sélectionner quatre affirmations exactes :
1- Dans le cas d’effort physique et de manque d’oxygène, la cellule peut faire une fermentation lactique pour régénérer du NAD+ et relancer la glycolyse
2- La glycolyse est constituée d’étapes qui se déroulent dans les mitochondries
3- Le NADH et le H+ de l’étape 6 de la glycolyse peuvent pénétrer dans les mitochondries pour y produire de l’ATP
4- En cas de manque d’oxygène, l’acide pyruvique est converti, par fermentation, en acide lactique. La fermentation lactique se fait dans le cytoplasme
5- [A] : le NADH s’oxyde en NAD+
6- [B] : il y a augmentation d’hydrogènes (donc d’électrons) = réduction du pyruvate en lactate
Les affirmations 1, 4, 5 et 6 sont exactes.
Affirmations 2 et 3
Non.
Revoir le chapitre « Respiration cellulaire ».
Rappels :
Processus de transport
Le processus de transport d’énergie (d’électrons) est :
1- Une réaction de catabolisme libère de l’énergie,
2- Par la suite, une réaction d’anabolisme/synthèse a besoin d’énergie,
- Un « transporteur » d’énergie sert de véhicule intermédiaire de transport.
Le transporteur d’énergie, une coenzyme (exemple : NAD+), se charge en énergie (en électrons), lors de la réaction de catabolisme et libère cette énergie, plus tard lors de la réaction d’anabolisme.
Conclusion :
Le transport d’énergie permet de transporter de l’énergie entre des réactions qui n’ont pas lieu au même instant.
Fermentations
Deux types de fermentations (selon l’enzyme présente dans la cellule) :
- Fermentation lactique
Dans l’organisme, la fermentation lactique est lancée, si le corps a besoin d’énergie, et si la respiration aérobie ne peut pas se faire. Par manque d’oxygène suite a un effort physique intense par exemple.
- Fermentation alcoolique
Les levures et les bactéries sont capables des deux types de fermentation.
Fermentation lactique
La fermentation lactique transforme le pyruvate en lactate (acide lactique).
Lors de la fermentation lactique, l’acide lactique provoque la baisse du pH qui modifie l’activité des enzymes et entraîne rigidité musculaire et fatigue.
Le foie, par la néoglucogenèse, transforme le lactate en glucose ; glucose évacué dans le sang et transformé en énergie par glycolyse et respiration aérobie.
Fermentation alcoolique
Le pyruvate est transformé en acétaldéhyde, lui-même transformé en éthanol.
Les levures et les bactéries sont capables des fermentations alcooliques.
Page 7.
Navette. Glycérol phosphate

Sélectionnez les deux affirmations exactes :
1- [A] : La glycolyse peut se faire sans régénération du NAD+
2- [A] : régénération du NAD+ : fermentation lactique, en cas d’effort intense, ou en condition normale par l’enzyme glycérol phosphate déshydrogénase cytosolique
3- [A] : La régénération du NAD+, réduit par l’étape 6 de la glycolyse, se fait par phosphorylation oxydative à l’intérieur des mitochondries
4- [B] : l’oxydation du NADH permet la réduction du dihydroxyacétone phosphate en navette glycérol phosphate
5- L’enzyme glycérol phosphate déshydrogénase de la mitochondrie n’a pas d’effet sur la molécule glycérol phosphate
Les affirmations 2 et 4 sont exactes.
Affirmation 1
Non.
La glycolyse nécessite du NAD+ disponible dans le cytosol : le NADH produit
par l’étape 6 de la glycolyse doit être réoxydé en NAD+
Affirmation 3
Non :
Le NADH du cytosol ne peut pas traverser la membrane interne des mitochondries.
Affirmation 5
Si.
Le glycérol phosphate y perd des atomes d’hydrogène ; il s’oxyde en dihydroxyacétone phosphate.
Rappels :
Navettes
- Glycérol phosphate,
- Malatte-aspartate (voir page suivante)
La navette glycérol phosphate permet de transférer les H+ et les électrons du NADH dans la matrice des mitochondries même si la molécule NADH ne peut pas traverser les membranes internes mitochondriales.
Page 8.
Navette. Malatte-aspartate

Sélectionner l’affirmation fausse :
1- [A] : MDH signifie malate dehydrogenase. Enzyme présente dans le cytosol et la matrice mitochondriale
2- L’excès de NADH est régulé par une réaction d’oxydation en NAD+ et une création de malate
3- Un excès de NADH dans le cytosol entraîne, par l’intermédiaire de la navette malate-aspartate, une création de NADH et d’ATP dans les mitochondries
4- Le NADH du cytosol peut traverser la membrane interne des mitochondries
L’affirmation 4 est fausse.
Rappels :
La navette malatte-aspartate régule les concentrations de NADH/NAD+ dans le cytosol
Le NADH excédentaire du cytosol est indirectement transféré en NADH mitochondrial pour y produire de l’ATP
Étapes
- L’excès de NADH est oxydé en NAD+
La réduction associée réduit de l’oxaloacétate en malate,
- Le malate traverse la membrane interne des mitochondries
- L’oxydation du malate en oxaloacétate induit une réduction du NAD+ en NADH mitochondrial. Ce NADH, par phosphorylation oxydative, produira de l’ATP.
Régénération :
- L’oxaloacétate
est, par réaction de transamination, transformé
en aspartate,
- L’aspartate traverse la membrane pour
revenir dans le cytosol.
- Une deuxième réaction de transamination retransforme l’aspartate en oxaloacétate,
Cet oxaloacétate régénéré est disponible pour être réduit à nouveau lors d’une régulation, par oxydation, du NADH en NAD+
Page 9.
Chaîne de transport d’électrons

Sélectionner les trois affirmations exactes :
1- [A] : La chaîne de respiration est dans la membrane interne mitochondriale
2- [A] : les complexes I, III et IV expulsent les protons H vers la matrice mitochondriale
3- [B] : acétyl coa provenant de l’oxydation du pyruvate (glycolyse), béta oxydation de l’acyl coa (hélice de Lynen/acide gras), transamination des acides aminés
4- [C] : NADH de la glycolyse qui traverse la membrane interne mitochondriale
5- [D] : Par une chaîne de réactions d’oxydoréductions, les électrons d’oxydation du NADH en NAD+, arrivent à l’accepteur final, l’oxygène moléculaire
Les affirmations 1, 3 et 5 sont exactes.
Affirmation 2
Non.
[A] : les complexes I, III et IV expulsent les protons H vers l’espace inter membranaire.
Affirmation 3
Oui.
L’oxydation du pyruvate en acétyl CoA se fait dans la mitochondrie avec dégagement d’une molécule de CO2. L’oxydation du pyruvate entraîne la réaction de réduction du NAD+ en NADH. Réaction catalysée par une enzyme, la pyruvate déshydrogénase.
Affirmation 4
Non.
[C] :
La membrane mitochondriale interne est imperméable
au NADH.
Le NADH excédentaire du cytosol est génère indirectement du NADH mitochondrial par la navette Malatte-aspartate.
La chaîne de respiration oxyde le NADH et le FADH2 en NAD+ et FAD et entraîne la création d’ATP par phosphorylation de l’ADP.
Affirmation 5
Oui.
Suivant l’équation :
O2 + 4 H+ + 4 e- --à 2 H2O
Rappels :
La chaîne de transport d’électrons (aussi appelée chaîne respiratoire) est constituée de 4 complexes protéiques :
- complexe I : NADH-coenzyme Q oxydoréductase,
- complexe II : succinate-coenzyme Q oxydoréductase,
- complexe III : coenzyme Q-cytochrome c oxydoréductase,
-
complexe IV : cytochrome c oxydase.
Le coenzyme Q (ubiquinone) et le cytochrome c sont des transporteurs mobiles
d’électrons.
Page 10.
L’oxygène dans la cellule. RLO

Sélectionner l’affirmation exacte :
1- [A] : dans les cellules, la réduction de l’oxygène se fait dans le cycle de Krebs des mitochondries
2- [A] : réduction de l’oxygène par fermentation lactique
3- [B] : représentation de Lewis du dioxygène : une triple liaison entre les deux atomes d’oxygène
4- [C] : le radical hydroxyle, fission de la liaison instable O-O de l’eau oxygénée H2O2, contient un électron libre. Le radical hydroxyle est très réactif
L’affirmation 4 est exacte.
Affirmation 1 :
Non.
[A] :
la réduction de l’oxygène se fait en fin de chaîne respiratoire, dans les
membranes internes des mitochondries.
L’équation de la réaction de réduction est :
O2 + 4 H+ + 4 e- --à 2 H2O
Affirmation 2
Non.
La fermentation lactique est une réaction en anaérobie qui se fait dans le cytoplasme.
Le pyruvate est réduit en lactate.
En condition d’efforts intenses et de manque d’oxygène, la réaction couplée oxyde le NADH et redonne du NAD+ nécessaire à la poursuite de la glycolyse.
Affirmation 4
Oui.
Radical (souvent appelé « Radical libre ») :
- structure chimique avec un, ou des, électron(s) célibataire(s) sur une des couches externes,
- se note avec un point (exemple : HO.),
- peut être chargé (exemple : ion superoxyde O2.- )
ou non chargé (exemple : monoxyde d’azote NO)
- sont instables, réagissent rapidement.
Rappels :
RLO : Radical Libre de l’Oxygène
Radical libre : atome ou molécule dont au moins une orbitale externe contient un électron libre = très instable.
Orbitale moléculaires : revoir le chapitre « Chimie – Molécule ».
Oxygène & RLO dans la cellule
Normalement, l’oxygène est entièrement réduit en eau dans les mitochondries [A].
L’équation de la réaction de réduction est :
O2 + 4 H+ + 4 e- --à 2 H2O
(Revoir la page « chaîne respiratoire »).
Des niveaux de réduction peuvent donner des radicaux superoxydes ou des ions peroxydes.
Par addition d’un proton H+, les ions peroxydes donnent de l’eau oxygénée H2O2 .
L’eau oxygénée, à liaison O-O instable, est à l’origine des radicaux hydroxyles HO. .
L’apport d’énergie nécessaire pour briser la liaison et produire des radicaux hydroxyles peut être la température, les rayons ionisants, ou la captation d’un électron par un ion métallique, Fe, Cu, (Réaction de Fenton).
Effets des RLO
Les radicaux hydroxyles HO. sont très réactifs.
Les radicaux hydroxyle sont capables d’oxyder les biomolécules :
- ADN : mort cellulaire, mutations carcinogènes,
- dépôts lipidiques peroxydés dans les vaisseaux et tissus, dérivés carcinogènes,
- dérèglements des signaux protéiniques de prolifération ou de défense, inhibitions enzymatiques, dépôts (fibroses et amyloïdoses).
Le stress oxydant est donc responsable du vieillissement, de cancers, de maladies cardio-vasculaires, de diabète, de sclérose latérales amyotrophiques, etc.
Lutte contre le stress oxydant
Quelques moyens de l’organisme pour lutter contre le déséquilibre oxydant de l’apparition de RLO :
- utilisation d’enzymes (superoxyde dismutase, peroxidase) pour transformer les radicaux superoxydes en peroxydes d’hydrogènes puis élimination,
- destruction des RLO par récupération de l’électron radicalaire (par des molécules glutathion, vitamines C, E, etc.),
- Fixer les ions métalliques par des protéines pour diminuer les réactions de Fenton.