Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page
1.
Acides aminés &
protéines

Sélectionner l’affirmation exacte :
1- Acides aminés : acides organiques contenant un groupement
amine. Un polymère
d'acides aminés est un « peptide » ; liaisons « peptidiques » entre acides
aminés
2- [A] : tous les acides aminés d’une protéine sont dans un
même plan et le nombre total d’acides aminés est faible
3- À de rares exceptions près, les protéines sont des successions
d’acides bêta aminés de la série D
4- [B] : liaisons peptidiques
L’affirmation 1 est exacte.
Affirmation 1
Oui.
Les acides organiques (ou acides carboxyliques), sont formés d’un groupement
carboxylique (-COOH) et d’un radical quelconque.
Exemple :
Acide formique : H-COOH
Acide acétique : CH3–COOH (dans le vinaigre ; antiseptique et
désinfectant)
Acide oxalique : CHOOH-CHOOH
Affirmation
3
Non.
À de rares exceptions près, les protéines sont des successions d’acides alpha aminés
de la série L.
(Revoir
le chapitre « Acides aminés »)
Rappels :
Acides
aminés
Les acides aminés (ou aminoacides), ont 2 groupes
fonctionnels :
- un groupement carboxyle –COOH
- un groupement amine –NH2.
Notes :
- Les
acides aminés d’une protéine sont aussi appelés « les résidus »,
- En
solution, les acides aminés s’ionisent
(Le
groupement amine gagne un proton hydrogène : NH3+,
et le groupement acide en perd un : COO-).
Protéines
Les
protéines sont des polymères d’acides aminés.
Toutes
les protéines de notre organisme sont construites
à partir de 20 acides aminés de base.
À partir
de ces 20 acides aminés de base, une cellule peut fabriquer en moyenne
15 000 sortes de protéines différentes
(200 000 protéines différentes environ dans
l’organisme).
Les protéines constituent plus de 50% du poids sec d’une
cellule.
Les
protéines sont le nutriment de base pour la formation des muscles.
Structure
des protéines
Les
acides aminés sont reliés entre eux par des liaisons
peptidiques pour former une chaîne
peptidique plus ou moins longue
La
plupart des protéines sont formées d’une chaîne de 100 à 200 acides aminés (Une
protéine peut être constituée de plus d’une chaîne polypeptidique).
Le nombre et la séquence des
acides aminés dans une chaîne peptidique sont spécifiques
à chaque protéine.
Page 2.
Chaîne polypeptidique
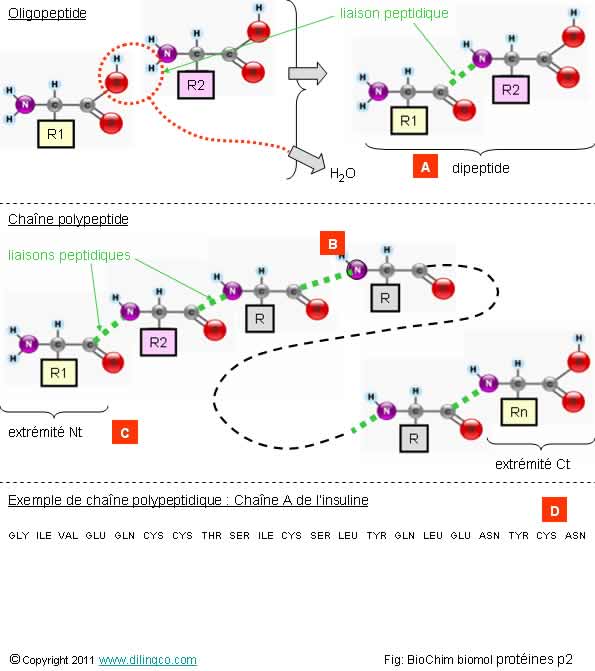
Sélectionner
les deux affirmations exactes :
1- Un
polypeptide est une chaîne d’acides aminés assez longue pour ne pas être classé
dans les oligopeptides
2- Une
protéine est toujours formée d’une seule chaîne polypeptidique
3- [A] :
tripeptide (trois peptides). Oligopeptide polymère de deux acides gras. Séquence
des acides gras codée dans l’ADN
4- [B] :
l’extrémité de la liaison peptidique est un atome de carbone
5- [C] :
début de la chaîne ; résidu Nt de la protéine (N = côté amine ; atome
azote)
6-
[D] : Ct de la chaîne polypeptidique : ASN : acide aspartique
Les
affirmations 1 et 5 sont exactes.
Affirmation
2
Non.
Affirmation
3
Non.
[A] :
Dipeptide ; formé de deux acides aminés (et non
d’acides gras !), identiques ou différents.
Les
peptides simples sont :
- classés
dans la famille des oligopeptides,
- ne sont
généralement pas issus de la traduction d’ARN mais d’une synthèse moléculaire
sous contrôle enzymatique.
Affirmation
5
Oui.
Résidu
Nt, ou extrémité Nt , ou Nt de la protéine.
Affirmation
6
Non.
Abréviations
d’acides aminés commençant par A :
A : Ala :
alanine
D : Asp :
acide aspartique
N : Asn : asparagine
R : Arg :
arginine
Rappels :
Oligopeptides
Les
oligopeptides sont la famille des peptides à
nombre d’acides aminés limité (quelques dizaines),
Ils ne
sont généralement pas issus de la traduction d’ARN
mais d’une synthèse enzymatique.
- 2
AA : dipeptides,
- 3
AA : tripeptides.
Polypeptides
Les polypeptides sont les chaînes d’acides aminés longues
(Jusqu’à
plusieurs milliers d’acides aminés).
Une ou plusieurs chaînes polypeptidiques forment une protéine.
Holoprotéines : chaînes peptidiques formées uniquement d’acides aminés.
Hétéroprotéine : Les hétéroprotéines contiennent en plus des AA, d’autres groupements.
Page 3.
Liaison peptidique
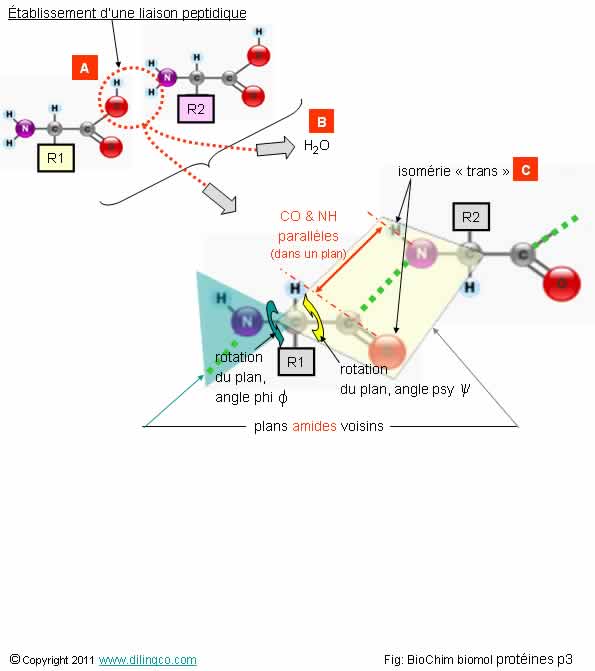
Sélectionner
les deux affirmations exactes :
1- [A] :
le groupement masqué est le groupement thiol (-SH)
2- [B] :
molécule d’eau. Les liaisons peptidiques se forment par condensation des acides
aminés lors de la traduction ou lors d’une synthèse enzymatique
3-
[C] : isomérie « trans ». L’isométrie trans présente le moins de
gène pour les radicaux : la plupart des AA consécutifs des chaînes
polypeptidiques sont « trans »
4- La
configuration spatiale, conséquence de l’orientation des plans amides
successifs, n’a pas d’importance pour les caractéristiques des protéines
5- La
réalisation d’une liaison peptidique ne nécessite pas d’énergie
Les
affirmations 2 et 3 sont exactes.
Affirmation
3
Oui.
Exceptions :
- Proline, le cycle pyrrole entraîne une
configuration cis plus probable,
- Glycine, pas de chaîne latérale : configurations cis et trans
possibles.
Note :
Dans le
cas d’acides gras insaturés (au moins une double liaison), on parle aussi
d’isomérie cis/trans.
Les acides gras naturels sont généralement «cis» ; les groupements situés du même côté
de la double liaison.
Détails :
Voir « Biomolécules, lipides ».
Affirmation
4
Si.
Exemple :
La
position et la conformation d’un site actif est fondamental pour l’effet
enzymatique.
Changer
un AA par un autre AA peut avoir des conséquences sur les valeurs des angles
psy et phi, et donc sur l’effet d’un enzyme, ou d’un médicament.
Rappels :
Isomérie
« cis » / « trans »
cis :
le O de C=O et le H de NH sont du même côté
de la liaison de la liaison peptidique (même remarque pour les chaîne latérales
adjacentes à ces atomes)
trans :
le O de C=O et le H de NH sont de part et d’autre
de la liaison de la liaison peptidique.
Angles
psi (Y) et phi (F)
Les
positions relatives des plans amides consécutifs sont caractérisés par les
angle psi et phi.
Toutes
les valeurs d’angles ne sont pas possibles et la valeur de l’un dépend de la
valeur de l’autre.
Le
diagramme de Ramachandran indique les valeurs possibles de l’angle phi en
fonction de l’angle psi suivant la structure secondaire probable (feuillet
bêta, hélice droite/gauche) considérée.
Page 4.
Repliements
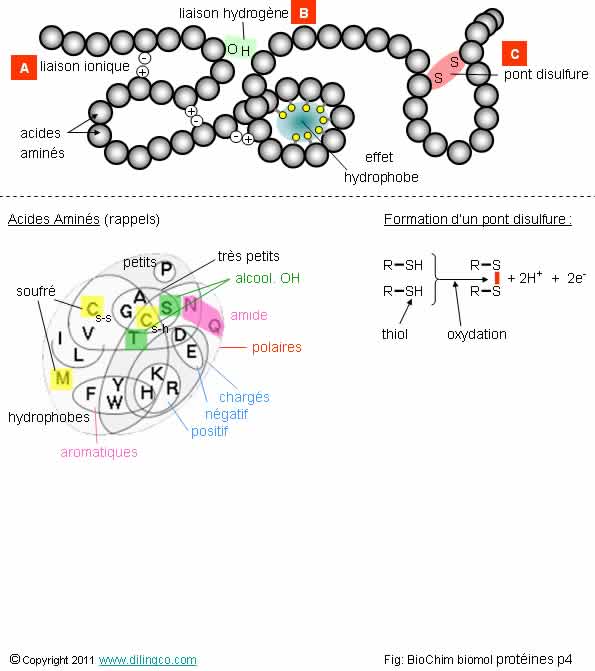
Sélectionner
les deux affirmations exactes :
1-
[A] : deux acides aminés E peuvent établir une liaison ionique
2-
[A] : deux acides aminés polaires voisins établissent des liaisons
ioniques entre eux
3- [B] : une liaison hydrogène résulte de l’attraction entre deux atomes d’hydrogène
4-
[C] : deux cystéines peuvent établir une liaison covalente entre les
atomes de souffre de leur chaîne latérale
5- La
forme tridimensionnelle d’une chaîne peptidique ne dépend pas de la chronologie
et de la nature des acides aminés qui la composent
6- Les AA
à radicaux hydrophobes sont plus attirés entre eux que par les molécules d’eau (ils
ont tendance à se replier et à se regrouper au centre de la protéine)
7- Le pH,
la chaleur, la concentration en électrolytes, ne peuvent pas dénaturer une
protéine (modifications sans effet sur sa forme et ses propriétés)
Les
affirmations 4 et 6 sont exactes.
Affirmation
1
Non.
Une
liaison ionique présuppose l’attraction entre des charges ioniques différentes.
Note :
E = Glu =
acide glutamique.
Affirmation
2
Non.
Ne pas
confondre :
-
Polaire/Apolaire (suivant le moment dipolaire résultant),
- La
charge ionique + ou –
Rappels :
- Moment
dipolaire : « Chimie, géométrie »,
-
Interactions moléculaires : « Chimie, Molécules ; Interactions
moléculaires ».
Affirmation
5
Si.
La
structure primaire (la liste des AA), d’une protéine détermine sa structure
tertiaire (spatiale).
Affirmation
7
Si.
Les
modifications des forces d’interactions peuvent modifier la forme (et les
propriétés qui y sont liées), d’une protéine.
Rappels :
Structure
spatiale
Les
chaînes polypeptidiques ne sont pas linéaires :
- Les
plans amides successifs ont des angles de rotation psy et phi,
- Les
radicaux des acides aminés qui composent la chaîne peuvent interagir entre eux
(s’attirer, se repousser), et entrent en ligne de compte dans la structure
tridimensionnelle obtenue.
Les
interactions entre chaînes latérales peuvent se faire entre acides aminés
consécutifs et/ou entre acides aminés de brins parallèles voisins.
Interactions
Les quatre grands types d’interactions qui jouent un
rôle dans le repliement des chaînes polypeptidiques sont :
- L’effet hydrophobe,
- Les liaisons ioniques,
- Les liaisons hydrogènes,
- Les ponts disulfures.
Les ponts
disulfures sont des liaisons covalentes (les plus fortes), et sont donc plus
difficile à briser que les autres liaisons.
Traduction
et repliements
L’assemblage
des acides aminés en protéines, « la
traduction », se fait dans le cytoplasme
de la cellule par décodage de l’ARN ou par synthèse enzymatique.
Les
repliements des chaînes polypeptidiques se font en cours de phase d’assemblage
par interactions des acides aminés progressivement assemblés.
Des
protéines spécifiques appelées « chaperonnes »
peuvent contribuer aux bons repliements des chaînes.
Page 5.
Types de repliements
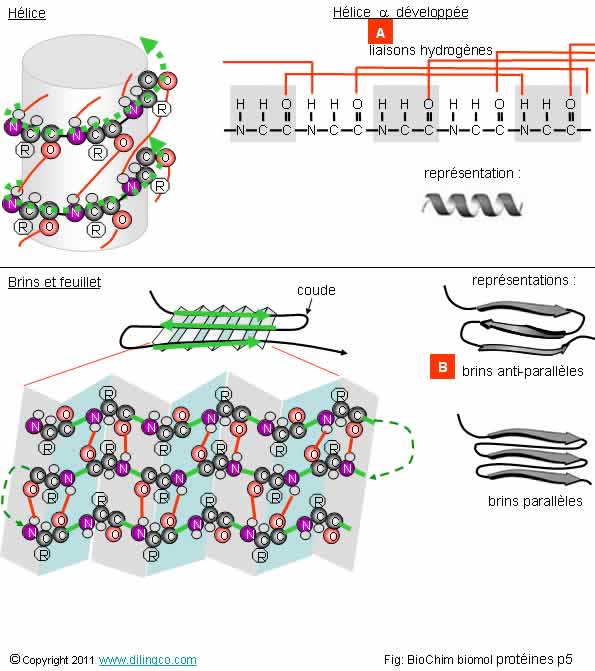
Sélectionner
l’affirmation exacte :
1- [A] :
Hélice 3 développée. (Lien hydrogène tous les trois résidus)
2- Un
feuillet bêta est obligatoirement constitué de trois brins parallèles
3-
[B] : Les brins n’ont pas la même orientation, la même polarité. Ils sont
des « brins anti-parallèles »
4- Il n’existe
qu’un seul type de coude
L’affirmation
3 est exacte.
Affirmation
1
Non.
[A]
Hélice alpha développée. (Lien hydrogène tous les quatre résidus)
Les
hélices alpha sont les plus fréquentes.
Dans
l’immense majorité des cas, les hélices tournent dans le sens des aiguilles d’une montre ; elles sont dites
« droites ».
(L’hélice
représentée est « gauche »).
Rappels :
Structures
secondaires
Certaines
parties d’une chaîne polypeptidique peuvent adoptent des structures régulières.
Ces conformations proviennent les angles entre plans amides successifs et de la
régularité/périodicité des interactions entre chaîne latérales des AA
successifs.
Les
structures types sont appelées, et classées, en « structures
secondaires » :
- Les hélices,
- Les feuillets,
- Les coudes.
Les hélices et les feuillets présentent des structures périodiques.
Hélices alpha
- Une liaison hydrogène relie les groupements
carbonyle et amide des acides aminés n et n+4,
- Les
hélices alpha sont les plus fréquentes.
Autres
hélices : hélices 310 (tous les 3 résidus), hélice de type II,
etc.
Feuillet
Bêta
- Un feuillet
se forme par liaisons hydrogènes entre brins parallèles,
- Les
feuillets Bêta ne sont pas plans : ils sont plissés,
- Les AA
sont situés alternativement sur les plans montants et descendants.
Coudes
Plusieurs
types de coudes ont été définis.
Les
coudes sont des repliements dus à des interactions particulières
(exemples : effet hydrophobe, liaisons ioniques).
Les
coudes peuvent s’oxyder.
Page 6.
Structures tertiaires

Sélectionner
l’affirmation exacte :
1- [A] :
La myoglobine a une chaîne de 8 hélices alpa reliées par des boucles. À cette
partie protéine « globine », s’ajoute une molécule appelée « hème »
2- [A] :
La myoglobine a une chaîne de 8 feuillets bêta reliées par des boucles. À cette
partie protéine « globine », s’ajoute une molécule appelée
« hème »
3-
[B] : cette protéine n’a pas de structure périodique de niveau secondaire
4-
[C] : l’ubiquitine est un acide gras
L’affirmation
1 est exacte.
Affirmation
3
Si.
Structures
périodiques de cette protéine :
- Une
hélice alpha,
-
plusieurs feuillets.
Affirmation
4
Non.
L'ubiquitine
est une protéine de 76 acides aminés.
Joue un
rôle important dans le marquage des protéines à éliminer en modifications
post-traductionnelle.
Rappels :
La structure tertiaire représente la conformation spatiale d’une chaîne d’acides
aminés.
Page 7.
Secondaire. Tertiaire.
Quaternaire
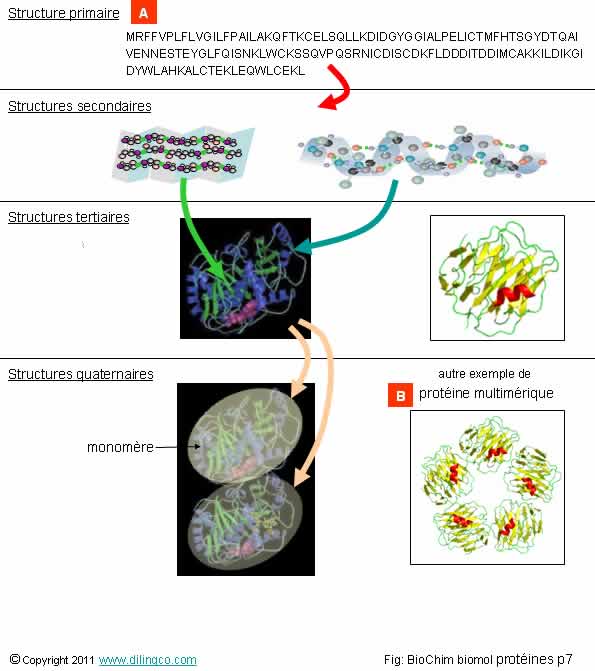
Sélectionner
les deux affirmations exactes :
1-
L’hélice alpha et le feuillet bêta sont deux grands types de structures
primaires d’une protéine
2- L’hémoglobine,
qui a une structure quaternaire, est constituée de quatre chaînes identiques
deux à deux
3- Les
protéines à une seule chaîne d’acides aminés n’ont pas de structure quaternaire
(seules les protéines multimériques ont une structure quaternaire)
4-
[A] : structure d’un acide aminé ; [B] : protéine multimétrique
Les affirmations
2 et 3 sont exactes.
Affirmation
1
Non.
L’hélice alpha et le feuillet bêta sont deux
grands types de structures secondaires
d’une protéine.
Affirmation
2
Oui.
Hémoglobine :
Les deux
chaînes alpha ont 141 acides aminés.
Les deux
chaînes bêta ont 146 acides amines.
Total :
574 acides aminés pour l’hémoglobine.
À chaque
chaîne est associée un groupement « Hème ».
D’où le
nom Hémoglobine = hème et globine
(globine : partie protéique).
Affirmation
4
Non.
[A] :
structure primaire d’une chaîne polypeptidique
(Liste
des acides aminés)
[B] :
protéine multimérique (et non multimétrique !)
Rappels :
Structures
4 structures sont à considérer pour présenter les protéines :
1- Structure
primaire (ou séquence) : liste des acides
aminés, en commençant par l’extrémité Nt de la protéine.
Pas de référence à la conformation spatiale de la protéine.
2- Structure
secondaire :
Liste des
éléments secondaires de repliements (hélices, feuillets, coudes) constituant la
protéine.
3- Structure
tertiaire : structure tridimensionnelle
d’une chaîne polypeptidique.
4- Structure
quaternaire : Une protéine peut avoir une structure quaternaire si
elle est composée de plusieurs chaînes :
- la
topologie de chaque chaîne est la structure tertiaire,
- la description topologique de l’ensemble des sous-unités
(des « monomères »), est la structure
quaternaire
Une protéine à plusieurs chaînes est dite « protéine
multimérique ».
Exemple :
L’insuline
est formée de deux chaînes A et B reliées par des ponts disulfures.
Évolutions
structurelles
1- Naissance dans les
ribosomes (« traduction ») :
Enchaînement d’acides amines = structure primaire
(Toutes
les protéines ont donc une structure primaire).
Evolutions
post-traductionnelles :
2- Déformations dues aux forces
d’attractions/répulsion
= structure secondaire
(Phase terminale pour les protéines fibreuses).
3-
évolutions supplémentaires en « structure
tertiaire » complexes
(Cas des protéines globulaires)
4-
Modifications post-traductionnelles éventuelles donnant des structures quaternaires (Coupures de chaînes et
attractions entre chaînes).
Les
structures quaternaires éventuelles ne concernent que les protéines qui ont
déjà une structure tertiaire ; les protéines globulaires.
5- La
protéine native peut subir des dénaturations au
cours de sa vie.
Les
agents dénaturants peuvent être physiques (température, ultrasons) ou chimiques
(acides forts, sels, détergents, urée).
Modifications
post-traduction
La chaîne
primaire obtenue en sortie des ribosomes peut subir des modifications très
diverses : clivage, élimination d’AA, acétylation,
hydroxylation, etc.
Ces
modifications, comme suggéré précédemment, peuvent impacter les quatre niveaux
de structures.
Page 8.
Classification / forme
Sélectionner
les deux affirmations exactes :
1- L’hémoglobine
(rôle de transporteur), l’insuline (hormone ; messager chimique) sont
des exemples de protéines globulaires solubles véhiculées dans le sang
2- Les
protéines fibreuses peuvent être des enzymes ou des hormones
3- Les
protéines fibreuses sont par nature insolubles (sinon les structures qu’elles
constituent se détruiraient)
4-
[A] : exemple de protéine globulaire
Les
affirmations 1 et 3 sont exactes.
Affirmation
2
Non.
Les protéines
fibreuses ne sont jamais des enzymes ou des
hormones.
Les protéines fibreuses sont des protéines de structures.
Les protéines fibreuses extracellulaires sont insolubles et elles ont un rôle
de protection.
Rappels :
Les
protéines peuvent être classées suivant :
- leurs formes,
(Fibreuses,
globuleuses)
- leurs compositions.
(Holoprotéine,
hétéroprotéines)
- l’emplacement où elles résident,
(Extra/intra
cellulaires, membranaires)
Mais
aussi suivant :
- leurs solubilités (soluble, soluble sous conditions,
insolubles
- et
surtout leurs rôles biologiques.
Formes
fibreuses & globuleuses
Deux
principales classes de protéines :
Les protéines fibreuses
- Longues
chaînes polypeptidiques en forme de filaments torsadés enroulés autour d’un axe
sous une forme hélicoïdale,
- Rôle structurels.
Les protéines globulaires
De nombreux rôles :
-
enzymatiques (exemple : enzymes de la classe des oxydo-réductases),
-
messagers chimiques (exemple : hormones),
-
transporteurs au niveau des membranes (exemple : hémoglobine).
-
stockage d’acides aminés.
Protéines
fibreuses
Les
protéines fibreuses constituent une des deux classes de protéines.
On peut
les substituer en plusieurs types :
- Les kératines. Tissus protecteurs. Epiderme. Poils.
Ongles
- Les collagènes. Tissus conjonctifs. Cartilages.
Tendons.
- Les élastines. Tissus conjonctifs. Vaisseaux
sanguins, ligaments.
Les protéines fibreuses peuvent aussi être intracellulaires.
Exemples :
Actine,
myosine.
(Révision :
figures extraites de « Anatomie. Introduction. Muscles »)
Protéines
globulaires
Les
protéines globulaires sont les protéines en forme
de « pelotes » plus ou moins complexes, de structures tertiaires ou quaternaires, présentées depuis le
début de ce chapitre.
Page 9.
Classification / composition
Sélectionner
l’affirmation exacte :
1- Prosthétique :
partie non protéique d’une protéine hétéroprotéine
2- Les
glycoprotéines ne sont pas des protéines
3-
[A] : l’hémoglobine est un exemple d’holoprotéine
4- La
myosine est une forme particulière de la myoglobine ; c’est une
hétéroprotéine
L’affirmation
1 est exacte.
Affirmation
1
Oui
Prosthétique :
prothèse à l’apoprotéine d’une hétéroprotéine (ouf !)
Les
groupements prosthétiques contiennent en général un ou plusieurs atomes
métalliques en leur centre.
Exemple :
L’hème de l’hémoglobine pour le transport de
l’oxygène dans le sang.
Affirmation
3
Non.
L’hémoglobine
contient un hème dans chaque une de ses
quatre chaînes. C’est un exemple d’hétéroprotéine
à structure quaternaire.
La
myoglobine, apparentée à l’hémoglobine, est un monomère (formée d’une seule
sous unité composée de 153 acides aminés et d’un hème).
Affirmation
4
Non.
Ne pas
confondre :
- La myosine,
Protéine de structure, composée de deux chaînes polypeptidiques d’environ 2000
acides aminés. Par les modifications de sa structure, la myosine est à la base
des mécanismes de contraction musculaire (voir chapitre anatomie,
introduction, muscle),
- La myoglobine,
Protéine globulaire des cellules musculaires, elle est apparentée à
l’hémoglobine (la myoglobine est un monomère alors que l’hémoglobine est un
tétramère).
La myoglobine est une hétéroprotéine contenant un hème.
A cause
de sa trop grande affinité à l’oxygène, la myoglobine n’est pas, comme l’hémoglobine,
une molécule de transport, mais plutôt une molécule de stockage de l’oxygène
dans les muscles.
Rappels :
Exemples
de classifications
Les
protéines peuvent être classées suivant leurs compositions.
Deux
grands types :
- Les
protéines ne contenant que des acides aminés « Holoprotéine »,
- les « hétéroprotéines », protéines avec une partie protéine
(l’apoprotéine), et une partie non protéique (exemple : ion Fe2+).
Hétéroprotéines
Suivant
l’élément ajouté :
Glycoprotéine (5 à 40% de glucides), peptidoglycane
(Plus de 90% de glucides),
Métalloprotéines (protéine contenant un cofacteur métallique),
Phosphoprotéine,
Chromoprotéine (protéine contenant un pigment),
Lipoprotéines (protéine contenant un lipide),
Nucléoprotéine (protéine contenant un acide nucléique).
Page 10.
Classification / emplacement
Sélectionner
les deux affirmations exactes :
1-
L’hémoglobine (rôle de transporteur), l’insuline (hormone ; messager
chimique) sont des exemples de protéines globulaires solubles et véhiculés dans
le sang
2- Les
protéines membranaires polytopiques ne sont en contact qu’avec un côté de la
membrane
3- Les
protéines membranaires monotopiques peuvent être intrinsèques ou extrinsèques
suivant leur degré d’attachement à la membrane
4-
Transport « passif » de molécule à travers la membrane : de
l’énergie (hydrolyse d’ATP) est consommée
Les
affirmations 1 et 3 sont exactes.
Affirmation
4
Non.
C’est le
contraire :
Le transport passif de molécule à travers la
membrane ne nécessite pas d’énergie ; Il se réalise par simple diffusion d’un côté à l’autre.
Le transport actif consomme de l’énergie.
Rappels :
Les
protéines peuvent être classées suivant l’emplacement
où elles résident (Extra/intra cellulaires, membranaires).
Protéines
membranaires
Les
protéines membranaires peuvent être :
- intégrées ou fortement liées à la membrane (protéines
intrinsèques) ou
- associées à la membrane (protéines extrinsèques).
Rôles :
-
Transport actif ou passif de molécules à travers la membrane,
-
Transmission des signaux chimiques à travers la membrane,
-
Reconnaissances intercellulaires,
-
enzymatiques,
- etc.
Page 11.
Classification / fonctions
Sélectionner
les deux affirmations exactes :
1-
[A] : le cholestérol n’a pas besoin d’être véhiculé dans le sang sous
forme de lipoprotéine
2- Il n’y
a pas de cholestérol dans les membranes cellulaires
3- C’est
grâce à des protéines polytopyques que les grosses molécules ou les ions
peuvent traverser les membranes
4-
[B] : des protéines membranaires ont une fonction « récepteur »
: elles fixent les ligand des signaux chimiques qui leur sont destinées
5- Les
membranes cytoplasmiques sont imperméables ; elles n’ont pas de rôles de
filtrages
6- Les
membranes cytoplasmiques sont formées d’une bicouche enzymatique
Les
affirmations 3 et 4 sont exactes.
Affirmation
1
Si.
Le
cholestérol est une molécule amphiphile,
à caractère lipidique, de la famille des stérols.
Le cholestérol est transporté dans le sang par une
lipoprotéine.
Révision :
- biochimie, biomolécules, Lipides.
- biochimie, métabolisme, Lipides.
Affirmation
2
Si.
Rôles du
cholestérol :
- contribue à la structure et à la stabilité des
membranes cellulaires,
-
précurseur de nombreuses molécules.
Affirmation
4
Oui.
Par
exemple, les ligands des hormones se
fixent sur les récepteurs de certaines
protéines pour n’influencer que certaines cellules spécifiques dites
« cellules cibles ».
Affirmation
6
Non.
Les
membranes cytoplasmiques sont formées d’une bicouche
phospolipidique. Les têtes hydrophiles sont tournées vers
l’extérieur de la cellule et vers le cytoplasme.
Rappels :
Exemples
de fonctions
- Structure et soutien
- Mouvements (actine / myosine)
- Catalyseurs biologiques (enzymes)
- Transport et stockage (hémoglobine, ferritine)
- Signalisation (hormones)
- Réception des signaux chimiques
- Défense contre les agressions biologiques
(anticorps)
Page
12
Sang & hémoglobine
Sélectionnez
les deux affirmations exactes :
1- Le plasma contient les éléments figurés du sang (exemple :
les hématies)
2-
[A] : myoglobine
3-
L’hémoglobine est une protéine à structure quaternaire formée de 4 chaînes
« globine » identiques 2 à 2 (2 alpha, 141 AA, et 2 bêta, 146 AA)
4- Chaque
globine contient un groupe hème. Un ion fe2+ est présent dans chaque hème
5- Le
globule rouge est un lymphocyte
Les
affirmations 3 et 4 sont exactes.
Affirmation
1
Non.
Le plasma est la partie liquide du sang.
Le plasma est principalement composé d'eau.
On y trouve des substances organiques, des
déchets, des éléments minéraux, des gaz dissous, des protéines (albumine,
lipoprotéines, globulines), etc.
Les éléments figurés du sang
sont :
- les globules rouges ou hématies ou érythrocytes,
- les globules blancs ou leucocytes,
- les plaquettes.
Un globule rouge contient environ 250 millions de molécules d’hémoglobines.
CCMH : de 32 à 36 g/100 mL.
CCMH :
Concentration corpusculaire moyenne en hémoglobine
Affirmation
2
Non.
Hémoglobine.
L’hémoglobine
contient un hème dans chaque une de ses
quatre chaînes. C’est un exemple d’hétéroprotéine
à structure quaternaire.
La
myoglobine, apparentée à l’hémoglobine, est un monomère (formée d’une seule
sous unité composée de 153 acides aminés et d’un hème).
De part
l’affinité à l’oxygène :
- L’hémoglobine est une protéine de transport
(Affinité
O2 variable en fonction du pH).
- La myoglobine est une protéine de stockage.
(Grande
affinité à l’oxygène).
Se rappeler :
Les
protéines peuvent être classées suivant leurs compositions.
Deux
grands types :
Les
« Holoprotéines », les
protéines ne contenant que des acides aminés.
Les « hétéroprotéines », protéines avec :
- une partie protéine (l’apoprotéine), et
- une partie non protéique (exemple : hème et ion Fe2+).
Ne pas
confondre :
- La myosine,
Protéine de structure, composée de deux chaînes polypeptidiques d’environ 2000
acides aminés. Par les modifications de sa structure, la myosine est à la base
des mécanismes de contraction musculaire
(Voir chapitre anatomie, introduction, muscle),
- La myoglobine,
Protéine globulaire des cellules musculaires, elle est apparentée à
l’hémoglobine (la myoglobine est un monomère alors que l’hémoglobine est un
tétramère).
La myoglobine est une hétéroprotéine contenant un hème.
A cause
de sa trop grande affinité à l’oxygène, la
myoglobine n’est pas, comme l’hémoglobine, une molécule de transport, mais plutôt une molécule de
stockage de l’oxygène dans les muscles.
Page 13.
Fonction transport de
l’hémoglobine
Sélectionner
les deux affirmations exactes :
1-
L’hémoglobine est une protéine à structure quaternaire formée de 4 chaînes
« globine » identiques 2 à 2 (2 alpha, 141 AA, et 2 bêta, 146 AA)
2-
L’hémoglobine est une protéine de stockage de l’oxygène (comme la myoglobine)
3- Le pH
ambiant agit sur la configuration spatiale de la molécule d’hémoglobine ;
La configuration spatiale modifie l’affinité à l’oxygène ou au gaz carbonique
4- Déoxyhémoglobine
= molécule d’hémoglobine chargée en oxygène
Les
affirmations 1 et 3 sont exactes.
Affirmation
2
Non.
L’hémoglobine est une protéine de transport :
- de l’O2,
ou
- du CO2
& H+
A cause
de sa trop grande affinité à l’oxygène, la
myoglobine n’est pas, comme l’hémoglobine
(affinité O2 variable en fonction du pH), une molécule de transport.
La myoglobine est une molécule de stockage de l’oxygène dans les muscles.
Texte d’explications :
Le rôle
principal de l’hémoglobine est :
- le transport de l’oxygène vers les tissus,
- l’évacuation des ions H+ et du CO2.
En présence d'oxygène, les sels ferreux
(Fe2+) s'oxydent/se réduisent
rapidement en fonction du pH. Ils servent au
transport O2.
Forme
R, relaxée
Dans
cette forme relaxée :
- La
molécule d’hémoglobine n’est pas chargée,
- La
cavité centrale est réduite,
- La
molécule d’hémoglobine a une forte affinité pour O2
(Et
faible pour CO2 et H+).
Chargement
en dioxygène
Figure
(1)
La
capture d’un O2 par une globine augmente l’affinité des autres
globines pour l’O2 : il y a interaction
coopérative entre globines et réaction en cascade accélérant la capture des dioxygènes.
Passage
de la forme R à la forme T, tendue
Figure
(2)
A
l’approche d’une cellule à pH bas, les hélices alpha des globines se modifient,
la cavité centrale s’agrandie, la position spatiale du Fe par rapport au plan
de l’anneau de porphyrine change.
L’affinité de l’hémoglobine à l’oxygène diminue.
Changement
de chargement
Figure
(3)
L’oxygène est libéré et capté par la cellule qui en a besoin.
Le pH de la cellule réceptrice d’oxygène augmente ; l’hémoglobine se charge en CO2 et ions H+
Libération
du CO2
Figure
(4)
Le CO2
de la molécule, alors appelée déoxyhémoglobine, est libérée dans les alvéoles
pulmonaires
Voir Système respiratoire.
L’hémoglobine
reprend sa forme relaxée, lui permettant de se recharger en O2.
Notes :
- Le CO2 se connecte aux extrémités N-terminales
des globines et il est facilement libérable.
- L’ion H+ se lie à des résidus des chaînes protéiques.
- En présence de monoxyde de carbone
CO, l’hémoglobine se charge en CO.
Le CO se fixe sur le fer, et, avec une
affinité beaucoup plus élevée que l’O2, est
difficile à déloger = intoxication.
Page 12.
Modif post-traduction, accidentelles
Synthèse
des protéines
Deux étapes
principales :
Transcription :
La
transcription de l’ADN en ARN messager se déroule dans le noyau des cellules
eucaryotes.
Traduction :
La
« traduction » est le processus qui permet d’obtenir la protéine à
partir des acides aminés et de l’information de séquençage contenu dans l’ARN.
La
traduction a lieu dans le cytoplasme cellulaire.
Exemples
de modifications
Il existe
de très nombreuses modifications post-traductionnelles qui permettent la
protéine définitive.
Parmi ces
modifications, citons :
- Le
clivage et réduction de la chaîne polypeptidique,
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Acides aminés & protéines

Sélectionner l’affirmation exacte :
1- Acides aminés : acides organiques contenant un groupement amine. Un polymère d'acides aminés est un « peptide » ; liaisons « peptidiques » entre acides aminés
2- [A] : tous les acides aminés d’une protéine sont dans un même plan et le nombre total d’acides aminés est faible
3- À de rares exceptions près, les protéines sont des successions d’acides bêta aminés de la série D
4- [B] : liaisons peptidiques
L’affirmation 1 est exacte.
Affirmation 1
Oui.
Les acides organiques (ou acides carboxyliques), sont formés d’un groupement carboxylique (-COOH) et d’un radical quelconque.
Exemple :
Acide formique : H-COOH
Acide acétique : CH3–COOH (dans le vinaigre ; antiseptique et désinfectant)
Acide oxalique : CHOOH-CHOOH
Affirmation 3
Non.
À de rares exceptions près, les protéines sont des successions d’acides alpha aminés de la série L.
(Revoir le chapitre « Acides aminés »)
Rappels :
Acides aminés
Les acides aminés (ou aminoacides), ont 2 groupes fonctionnels :
- un groupement carboxyle –COOH
- un groupement amine –NH2.
Notes :
- Les acides aminés d’une protéine sont aussi appelés « les résidus »,
- En solution, les acides aminés s’ionisent
(Le groupement amine gagne un proton hydrogène : NH3+, et le groupement acide en perd un : COO-).
Protéines
Les protéines sont des polymères d’acides aminés.
Toutes les protéines de notre organisme sont construites à partir de 20 acides aminés de base.
À partir de ces 20 acides aminés de base, une cellule peut fabriquer en moyenne 15 000 sortes de protéines différentes
(200 000 protéines différentes environ dans l’organisme).
Les protéines constituent plus de 50% du poids sec d’une cellule.
Les protéines sont le nutriment de base pour la formation des muscles.
Structure des protéines
Les acides aminés sont reliés entre eux par des liaisons peptidiques pour former une chaîne peptidique plus ou moins longue
La plupart des protéines sont formées d’une chaîne de 100 à 200 acides aminés (Une protéine peut être constituée de plus d’une chaîne polypeptidique).
Le nombre et la séquence des acides aminés dans une chaîne peptidique sont spécifiques à chaque protéine.
Page 2.
Chaîne polypeptidique

Sélectionner les deux affirmations exactes :
1- Un polypeptide est une chaîne d’acides aminés assez longue pour ne pas être classé dans les oligopeptides
2- Une protéine est toujours formée d’une seule chaîne polypeptidique
3- [A] : tripeptide (trois peptides). Oligopeptide polymère de deux acides gras. Séquence des acides gras codée dans l’ADN
4- [B] : l’extrémité de la liaison peptidique est un atome de carbone
5- [C] : début de la chaîne ; résidu Nt de la protéine (N = côté amine ; atome azote)
6- [D] : Ct de la chaîne polypeptidique : ASN : acide aspartique
Les affirmations 1 et 5 sont exactes.
Affirmation 2
Non.
Affirmation 3
Non.
[A] : Dipeptide ; formé de deux acides aminés (et non d’acides gras !), identiques ou différents.
Les peptides simples sont :
- classés dans la famille des oligopeptides,
- ne sont généralement pas issus de la traduction d’ARN mais d’une synthèse moléculaire sous contrôle enzymatique.
Affirmation 5
Oui.
Résidu Nt, ou extrémité Nt , ou Nt de la protéine.
Affirmation 6
Non.
Abréviations d’acides aminés commençant par A :
A : Ala : alanine
D : Asp : acide aspartique
N : Asn : asparagine
R : Arg : arginine
Rappels :
Oligopeptides
Les oligopeptides sont la famille des peptides à nombre d’acides aminés limité (quelques dizaines),
Ils ne sont généralement pas issus de la traduction d’ARN mais d’une synthèse enzymatique.
- 2 AA : dipeptides,
- 3 AA : tripeptides.
Polypeptides
Les polypeptides sont les chaînes d’acides aminés longues
(Jusqu’à
plusieurs milliers d’acides aminés).
Une ou plusieurs chaînes polypeptidiques forment une protéine.
Holoprotéines : chaînes peptidiques formées uniquement d’acides aminés.
Hétéroprotéine : Les hétéroprotéines contiennent en plus des AA, d’autres groupements.
Page 3.
Liaison peptidique

Sélectionner les deux affirmations exactes :
1- [A] : le groupement masqué est le groupement thiol (-SH)
2- [B] : molécule d’eau. Les liaisons peptidiques se forment par condensation des acides aminés lors de la traduction ou lors d’une synthèse enzymatique
3- [C] : isomérie « trans ». L’isométrie trans présente le moins de gène pour les radicaux : la plupart des AA consécutifs des chaînes polypeptidiques sont « trans »
4- La configuration spatiale, conséquence de l’orientation des plans amides successifs, n’a pas d’importance pour les caractéristiques des protéines
5- La réalisation d’une liaison peptidique ne nécessite pas d’énergie
Les affirmations 2 et 3 sont exactes.
Affirmation 3
Oui.
Exceptions :
- Proline, le cycle pyrrole entraîne une configuration cis plus probable,
- Glycine, pas de chaîne latérale : configurations cis et trans possibles.
Note :
Dans le cas d’acides gras insaturés (au moins une double liaison), on parle aussi d’isomérie cis/trans.
Les acides gras naturels sont généralement «cis» ; les groupements situés du même côté de la double liaison.
Détails : Voir « Biomolécules, lipides ».
Affirmation 4
Si.
Exemple :
La position et la conformation d’un site actif est fondamental pour l’effet enzymatique.
Changer un AA par un autre AA peut avoir des conséquences sur les valeurs des angles psy et phi, et donc sur l’effet d’un enzyme, ou d’un médicament.
Rappels :
Isomérie « cis » / « trans »
cis : le O de C=O et le H de NH sont du même côté de la liaison de la liaison peptidique (même remarque pour les chaîne latérales adjacentes à ces atomes)
trans : le O de C=O et le H de NH sont de part et d’autre de la liaison de la liaison peptidique.
Angles psi (Y) et phi (F)
Les positions relatives des plans amides consécutifs sont caractérisés par les angle psi et phi.
Toutes les valeurs d’angles ne sont pas possibles et la valeur de l’un dépend de la valeur de l’autre.
Le diagramme de Ramachandran indique les valeurs possibles de l’angle phi en fonction de l’angle psi suivant la structure secondaire probable (feuillet bêta, hélice droite/gauche) considérée.
Page 4.
Repliements

Sélectionner les deux affirmations exactes :
1- [A] : deux acides aminés E peuvent établir une liaison ionique
2-
[A] : deux acides aminés polaires voisins établissent des liaisons
ioniques entre eux
3- [B] : une liaison hydrogène résulte de l’attraction entre deux atomes d’hydrogène
4- [C] : deux cystéines peuvent établir une liaison covalente entre les atomes de souffre de leur chaîne latérale
5- La forme tridimensionnelle d’une chaîne peptidique ne dépend pas de la chronologie et de la nature des acides aminés qui la composent
6- Les AA à radicaux hydrophobes sont plus attirés entre eux que par les molécules d’eau (ils ont tendance à se replier et à se regrouper au centre de la protéine)
7- Le pH, la chaleur, la concentration en électrolytes, ne peuvent pas dénaturer une protéine (modifications sans effet sur sa forme et ses propriétés)
Les affirmations 4 et 6 sont exactes.
Affirmation 1
Non.
Une liaison ionique présuppose l’attraction entre des charges ioniques différentes.
Note :
E = Glu = acide glutamique.
Affirmation 2
Non.
Ne pas confondre :
- Polaire/Apolaire (suivant le moment dipolaire résultant),
- La charge ionique + ou –
Rappels :
- Moment dipolaire : « Chimie, géométrie »,
- Interactions moléculaires : « Chimie, Molécules ; Interactions moléculaires ».
Affirmation 5
Si.
La structure primaire (la liste des AA), d’une protéine détermine sa structure tertiaire (spatiale).
Affirmation 7
Si.
Les modifications des forces d’interactions peuvent modifier la forme (et les propriétés qui y sont liées), d’une protéine.
Rappels :
Structure spatiale
Les chaînes polypeptidiques ne sont pas linéaires :
- Les plans amides successifs ont des angles de rotation psy et phi,
- Les radicaux des acides aminés qui composent la chaîne peuvent interagir entre eux (s’attirer, se repousser), et entrent en ligne de compte dans la structure tridimensionnelle obtenue.
Les interactions entre chaînes latérales peuvent se faire entre acides aminés consécutifs et/ou entre acides aminés de brins parallèles voisins.
Interactions
Les quatre grands types d’interactions qui jouent un rôle dans le repliement des chaînes polypeptidiques sont :
- L’effet hydrophobe,
- Les liaisons ioniques,
- Les liaisons hydrogènes,
- Les ponts disulfures.
Les ponts disulfures sont des liaisons covalentes (les plus fortes), et sont donc plus difficile à briser que les autres liaisons.
Traduction et repliements
L’assemblage des acides aminés en protéines, « la traduction », se fait dans le cytoplasme de la cellule par décodage de l’ARN ou par synthèse enzymatique.
Les repliements des chaînes polypeptidiques se font en cours de phase d’assemblage par interactions des acides aminés progressivement assemblés.
Des protéines spécifiques appelées « chaperonnes » peuvent contribuer aux bons repliements des chaînes.
Page 5.
Types de repliements

Sélectionner l’affirmation exacte :
1- [A] : Hélice 3 développée. (Lien hydrogène tous les trois résidus)
2- Un feuillet bêta est obligatoirement constitué de trois brins parallèles
3- [B] : Les brins n’ont pas la même orientation, la même polarité. Ils sont des « brins anti-parallèles »
4- Il n’existe qu’un seul type de coude
L’affirmation 3 est exacte.
Affirmation 1
Non.
[A] Hélice alpha développée. (Lien hydrogène tous les quatre résidus)
Les hélices alpha sont les plus fréquentes.
Dans l’immense majorité des cas, les hélices tournent dans le sens des aiguilles d’une montre ; elles sont dites « droites ».
(L’hélice représentée est « gauche »).
Rappels :
Structures secondaires
Certaines parties d’une chaîne polypeptidique peuvent adoptent des structures régulières. Ces conformations proviennent les angles entre plans amides successifs et de la régularité/périodicité des interactions entre chaîne latérales des AA successifs.
Les structures types sont appelées, et classées, en « structures secondaires » :
- Les hélices,
- Les feuillets,
- Les coudes.
Les hélices et les feuillets présentent des structures périodiques.
Hélices alpha
- Une liaison hydrogène relie les groupements carbonyle et amide des acides aminés n et n+4,
- Les hélices alpha sont les plus fréquentes.
Autres hélices : hélices 310 (tous les 3 résidus), hélice de type II, etc.
Feuillet Bêta
- Un feuillet se forme par liaisons hydrogènes entre brins parallèles,
- Les feuillets Bêta ne sont pas plans : ils sont plissés,
- Les AA sont situés alternativement sur les plans montants et descendants.
Coudes
Plusieurs types de coudes ont été définis.
Les coudes sont des repliements dus à des interactions particulières (exemples : effet hydrophobe, liaisons ioniques).
Les coudes peuvent s’oxyder.
Page 6.
Structures tertiaires

Sélectionner l’affirmation exacte :
1- [A] : La myoglobine a une chaîne de 8 hélices alpa reliées par des boucles. À cette partie protéine « globine », s’ajoute une molécule appelée « hème »
2- [A] : La myoglobine a une chaîne de 8 feuillets bêta reliées par des boucles. À cette partie protéine « globine », s’ajoute une molécule appelée « hème »
3- [B] : cette protéine n’a pas de structure périodique de niveau secondaire
4- [C] : l’ubiquitine est un acide gras
L’affirmation 1 est exacte.
Affirmation 3
Si.
Structures périodiques de cette protéine :
- Une hélice alpha,
- plusieurs feuillets.
Affirmation 4
Non.
L'ubiquitine est une protéine de 76 acides aminés.
Joue un rôle important dans le marquage des protéines à éliminer en modifications post-traductionnelle.
Rappels :
La structure tertiaire représente la conformation spatiale d’une chaîne d’acides aminés.
Page 7.
Secondaire. Tertiaire. Quaternaire

Sélectionner les deux affirmations exactes :
1- L’hélice alpha et le feuillet bêta sont deux grands types de structures primaires d’une protéine
2- L’hémoglobine, qui a une structure quaternaire, est constituée de quatre chaînes identiques deux à deux
3- Les protéines à une seule chaîne d’acides aminés n’ont pas de structure quaternaire (seules les protéines multimériques ont une structure quaternaire)
4- [A] : structure d’un acide aminé ; [B] : protéine multimétrique
Les affirmations 2 et 3 sont exactes.
Affirmation 1
Non.
L’hélice alpha et le feuillet bêta sont deux grands types de structures secondaires d’une protéine.
Affirmation 2
Oui.
Hémoglobine :
Les deux chaînes alpha ont 141 acides aminés.
Les deux chaînes bêta ont 146 acides amines.
Total : 574 acides aminés pour l’hémoglobine.
À chaque chaîne est associée un groupement « Hème ».
D’où le nom Hémoglobine = hème et globine (globine : partie protéique).
Affirmation 4
Non.
[A] : structure primaire d’une chaîne polypeptidique
(Liste des acides aminés)
[B] : protéine multimérique (et non multimétrique !)
Rappels :
Structures
4 structures sont à considérer pour présenter les protéines :
1- Structure primaire (ou séquence) : liste des acides aminés, en commençant par l’extrémité Nt de la protéine.
Pas de référence à la conformation spatiale de la protéine.
2- Structure secondaire :
Liste des éléments secondaires de repliements (hélices, feuillets, coudes) constituant la protéine.
3- Structure tertiaire : structure tridimensionnelle d’une chaîne polypeptidique.
4- Structure quaternaire : Une protéine peut avoir une structure quaternaire si elle est composée de plusieurs chaînes :
- la topologie de chaque chaîne est la structure tertiaire,
- la description topologique de l’ensemble des sous-unités
(des « monomères »), est la structure
quaternaire
Une protéine à plusieurs chaînes est dite « protéine
multimérique ».
Exemple :
L’insuline est formée de deux chaînes A et B reliées par des ponts disulfures.
Évolutions structurelles
1- Naissance dans les ribosomes (« traduction ») :
Enchaînement d’acides amines = structure primaire
(Toutes les protéines ont donc une structure primaire).
Evolutions post-traductionnelles :
2- Déformations dues aux forces d’attractions/répulsion
= structure secondaire
(Phase terminale pour les protéines fibreuses).
3- évolutions supplémentaires en « structure tertiaire » complexes
(Cas des protéines globulaires)
4- Modifications post-traductionnelles éventuelles donnant des structures quaternaires (Coupures de chaînes et attractions entre chaînes).
Les structures quaternaires éventuelles ne concernent que les protéines qui ont déjà une structure tertiaire ; les protéines globulaires.
5- La protéine native peut subir des dénaturations au cours de sa vie.
Les agents dénaturants peuvent être physiques (température, ultrasons) ou chimiques (acides forts, sels, détergents, urée).
Modifications post-traduction
La chaîne primaire obtenue en sortie des ribosomes peut subir des modifications très diverses : clivage, élimination d’AA, acétylation, hydroxylation, etc.
Ces modifications, comme suggéré précédemment, peuvent impacter les quatre niveaux de structures.
Page 8.
Classification / forme

Sélectionner les deux affirmations exactes :
1- L’hémoglobine (rôle de transporteur), l’insuline (hormone ; messager chimique) sont des exemples de protéines globulaires solubles véhiculées dans le sang
2- Les protéines fibreuses peuvent être des enzymes ou des hormones
3- Les protéines fibreuses sont par nature insolubles (sinon les structures qu’elles constituent se détruiraient)
4- [A] : exemple de protéine globulaire
Les affirmations 1 et 3 sont exactes.
Affirmation 2
Non.
Les protéines fibreuses ne sont jamais des enzymes ou des hormones.
Les protéines fibreuses sont des protéines de structures.
Les protéines fibreuses extracellulaires sont insolubles et elles ont un rôle
de protection.
Rappels :
Les protéines peuvent être classées suivant :
- leurs formes,
(Fibreuses, globuleuses)
- leurs compositions.
(Holoprotéine, hétéroprotéines)
- l’emplacement où elles résident,
(Extra/intra cellulaires, membranaires)
Mais aussi suivant :
- leurs solubilités (soluble, soluble sous conditions, insolubles
- et surtout leurs rôles biologiques.
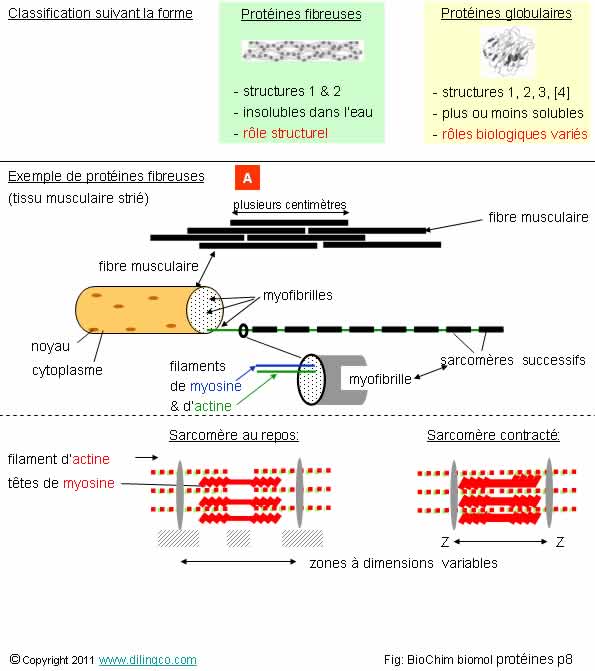
Formes fibreuses & globuleuses
Deux principales classes de protéines :
Les protéines fibreuses
- Longues chaînes polypeptidiques en forme de filaments torsadés enroulés autour d’un axe sous une forme hélicoïdale,
- Rôle structurels.
Les protéines globulaires
De nombreux rôles :
- enzymatiques (exemple : enzymes de la classe des oxydo-réductases),
- messagers chimiques (exemple : hormones),
- transporteurs au niveau des membranes (exemple : hémoglobine).
- stockage d’acides aminés.
Protéines fibreuses
Les protéines fibreuses constituent une des deux classes de protéines.
On peut les substituer en plusieurs types :
- Les kératines. Tissus protecteurs. Epiderme. Poils. Ongles
- Les collagènes. Tissus conjonctifs. Cartilages. Tendons.
- Les élastines. Tissus conjonctifs. Vaisseaux sanguins, ligaments.
Les protéines fibreuses peuvent aussi être intracellulaires.
Exemples :
Actine, myosine.
(Révision : figures extraites de « Anatomie. Introduction. Muscles »)
Protéines globulaires
Les protéines globulaires sont les protéines en forme de « pelotes » plus ou moins complexes, de structures tertiaires ou quaternaires, présentées depuis le début de ce chapitre.
Page 9.
Classification / composition
Sélectionner l’affirmation exacte :
1- Prosthétique : partie non protéique d’une protéine hétéroprotéine
2- Les glycoprotéines ne sont pas des protéines
3- [A] : l’hémoglobine est un exemple d’holoprotéine
4- La myosine est une forme particulière de la myoglobine ; c’est une hétéroprotéine
L’affirmation 1 est exacte.
Affirmation 1
Oui
Prosthétique : prothèse à l’apoprotéine d’une hétéroprotéine (ouf !)
Les groupements prosthétiques contiennent en général un ou plusieurs atomes métalliques en leur centre.
Exemple :
L’hème de l’hémoglobine pour le transport de l’oxygène dans le sang.
Affirmation 3
Non.
L’hémoglobine contient un hème dans chaque une de ses quatre chaînes. C’est un exemple d’hétéroprotéine à structure quaternaire.
La myoglobine, apparentée à l’hémoglobine, est un monomère (formée d’une seule sous unité composée de 153 acides aminés et d’un hème).
Affirmation 4
Non.
Ne pas confondre :
- La myosine,
Protéine de structure, composée de deux chaînes polypeptidiques d’environ 2000 acides aminés. Par les modifications de sa structure, la myosine est à la base des mécanismes de contraction musculaire (voir chapitre anatomie, introduction, muscle),
- La myoglobine,
Protéine globulaire des cellules musculaires, elle est apparentée à
l’hémoglobine (la myoglobine est un monomère alors que l’hémoglobine est un
tétramère).
La myoglobine est une hétéroprotéine contenant un hème.
A cause de sa trop grande affinité à l’oxygène, la myoglobine n’est pas, comme l’hémoglobine, une molécule de transport, mais plutôt une molécule de stockage de l’oxygène dans les muscles.
Rappels :
Exemples de classifications
Les protéines peuvent être classées suivant leurs compositions.
Deux grands types :
- Les protéines ne contenant que des acides aminés « Holoprotéine »,
- les « hétéroprotéines », protéines avec une partie protéine (l’apoprotéine), et une partie non protéique (exemple : ion Fe2+).
Hétéroprotéines
Suivant l’élément ajouté :
Glycoprotéine (5 à 40% de glucides), peptidoglycane (Plus de 90% de glucides),
Métalloprotéines (protéine contenant un cofacteur métallique),
Phosphoprotéine,
Chromoprotéine (protéine contenant un pigment),
Lipoprotéines (protéine contenant un lipide),
Nucléoprotéine (protéine contenant un acide nucléique).
Page 10.
Classification / emplacement
Sélectionner les deux affirmations exactes :
1- L’hémoglobine (rôle de transporteur), l’insuline (hormone ; messager chimique) sont des exemples de protéines globulaires solubles et véhiculés dans le sang
2- Les protéines membranaires polytopiques ne sont en contact qu’avec un côté de la membrane
3- Les protéines membranaires monotopiques peuvent être intrinsèques ou extrinsèques suivant leur degré d’attachement à la membrane
4- Transport « passif » de molécule à travers la membrane : de l’énergie (hydrolyse d’ATP) est consommée
Les affirmations 1 et 3 sont exactes.
Affirmation 4
Non.
C’est le contraire :
Le transport passif de molécule à travers la
membrane ne nécessite pas d’énergie ; Il se réalise par simple diffusion d’un côté à l’autre.
Le transport actif consomme de l’énergie.
Rappels :
Les protéines peuvent être classées suivant l’emplacement où elles résident (Extra/intra cellulaires, membranaires).
Protéines membranaires
Les protéines membranaires peuvent être :
- intégrées ou fortement liées à la membrane (protéines intrinsèques) ou
- associées à la membrane (protéines extrinsèques).
Rôles :
- Transport actif ou passif de molécules à travers la membrane,
- Transmission des signaux chimiques à travers la membrane,
- Reconnaissances intercellulaires,
- enzymatiques,
- etc.
Page 11.
Classification / fonctions
Sélectionner les deux affirmations exactes :
1- [A] : le cholestérol n’a pas besoin d’être véhiculé dans le sang sous forme de lipoprotéine
2- Il n’y a pas de cholestérol dans les membranes cellulaires
3- C’est grâce à des protéines polytopyques que les grosses molécules ou les ions peuvent traverser les membranes
4- [B] : des protéines membranaires ont une fonction « récepteur » : elles fixent les ligand des signaux chimiques qui leur sont destinées
5- Les membranes cytoplasmiques sont imperméables ; elles n’ont pas de rôles de filtrages
6- Les membranes cytoplasmiques sont formées d’une bicouche enzymatique
Les affirmations 3 et 4 sont exactes.
Affirmation 1
Si.
Le
cholestérol est une molécule amphiphile,
à caractère lipidique, de la famille des stérols.
Le cholestérol est transporté dans le sang par une
lipoprotéine.
Révision :
- biochimie, biomolécules, Lipides.
- biochimie, métabolisme, Lipides.
Affirmation 2
Si.
Rôles du
cholestérol :
- contribue à la structure et à la stabilité des
membranes cellulaires,
- précurseur de nombreuses molécules.
Affirmation 4
Oui.
Par exemple, les ligands des hormones se fixent sur les récepteurs de certaines protéines pour n’influencer que certaines cellules spécifiques dites « cellules cibles ».
Affirmation 6
Non.
Les membranes cytoplasmiques sont formées d’une bicouche phospolipidique. Les têtes hydrophiles sont tournées vers l’extérieur de la cellule et vers le cytoplasme.
Rappels :
Exemples
de fonctions
- Structure et soutien
- Mouvements (actine / myosine)
- Catalyseurs biologiques (enzymes)
- Transport et stockage (hémoglobine, ferritine)
- Signalisation (hormones)
- Réception des signaux chimiques
- Défense contre les agressions biologiques
(anticorps)
Page
12
Sang & hémoglobine
Sélectionnez les deux affirmations exactes :
1- Le plasma contient les éléments figurés du sang (exemple : les hématies)
2- [A] : myoglobine
3- L’hémoglobine est une protéine à structure quaternaire formée de 4 chaînes « globine » identiques 2 à 2 (2 alpha, 141 AA, et 2 bêta, 146 AA)
4- Chaque globine contient un groupe hème. Un ion fe2+ est présent dans chaque hème
5- Le globule rouge est un lymphocyte
Les affirmations 3 et 4 sont exactes.
Affirmation 1
Non.
Le plasma est la partie liquide du sang.
Le plasma est principalement composé d'eau.
On y trouve des substances organiques, des
déchets, des éléments minéraux, des gaz dissous, des protéines (albumine,
lipoprotéines, globulines), etc.
Les éléments figurés du sang
sont :
- les globules rouges ou hématies ou érythrocytes,
- les globules blancs ou leucocytes,
- les plaquettes.
Un globule rouge contient environ 250 millions de molécules d’hémoglobines.
CCMH : de 32 à 36 g/100 mL.
CCMH : Concentration corpusculaire moyenne en hémoglobine
Affirmation 2
Non.
Hémoglobine.
L’hémoglobine contient un hème dans chaque une de ses quatre chaînes. C’est un exemple d’hétéroprotéine à structure quaternaire.
La myoglobine, apparentée à l’hémoglobine, est un monomère (formée d’une seule sous unité composée de 153 acides aminés et d’un hème).
De part l’affinité à l’oxygène :
- L’hémoglobine est une protéine de transport
(Affinité O2 variable en fonction du pH).
- La myoglobine est une protéine de stockage.
(Grande affinité à l’oxygène).
Se rappeler :
Les protéines peuvent être classées suivant leurs compositions.
Deux grands types :
Les « Holoprotéines », les protéines ne contenant que des acides aminés.
Les « hétéroprotéines », protéines avec :
- une partie protéine (l’apoprotéine), et
- une partie non protéique (exemple : hème et ion Fe2+).
Ne pas confondre :
- La myosine,
Protéine de structure, composée de deux chaînes polypeptidiques d’environ 2000 acides aminés. Par les modifications de sa structure, la myosine est à la base des mécanismes de contraction musculaire
(Voir chapitre anatomie, introduction, muscle),
- La myoglobine,
Protéine globulaire des cellules musculaires, elle est apparentée à
l’hémoglobine (la myoglobine est un monomère alors que l’hémoglobine est un
tétramère).
La myoglobine est une hétéroprotéine contenant un hème.
A cause de sa trop grande affinité à l’oxygène, la myoglobine n’est pas, comme l’hémoglobine, une molécule de transport, mais plutôt une molécule de stockage de l’oxygène dans les muscles.
Page 13.
Fonction transport de l’hémoglobine
Sélectionner les deux affirmations exactes :
1- L’hémoglobine est une protéine à structure quaternaire formée de 4 chaînes « globine » identiques 2 à 2 (2 alpha, 141 AA, et 2 bêta, 146 AA)
2- L’hémoglobine est une protéine de stockage de l’oxygène (comme la myoglobine)
3- Le pH ambiant agit sur la configuration spatiale de la molécule d’hémoglobine ; La configuration spatiale modifie l’affinité à l’oxygène ou au gaz carbonique
4- Déoxyhémoglobine = molécule d’hémoglobine chargée en oxygène
Les affirmations 1 et 3 sont exactes.
Affirmation 2
Non.
L’hémoglobine est une protéine de transport :
- de l’O2, ou
- du CO2 & H+
A cause
de sa trop grande affinité à l’oxygène, la
myoglobine n’est pas, comme l’hémoglobine
(affinité O2 variable en fonction du pH), une molécule de transport.
La myoglobine est une molécule de stockage de l’oxygène dans les muscles.
Texte d’explications :
Le rôle principal de l’hémoglobine est :
- le transport de l’oxygène vers les tissus,
- l’évacuation des ions H+ et du CO2.
En présence d'oxygène, les sels ferreux (Fe2+) s'oxydent/se réduisent rapidement en fonction du pH. Ils servent au transport O2.
Forme R, relaxée
Dans cette forme relaxée :
- La molécule d’hémoglobine n’est pas chargée,
- La cavité centrale est réduite,
- La molécule d’hémoglobine a une forte affinité pour O2
(Et faible pour CO2 et H+).
Chargement en dioxygène
Figure (1)
La capture d’un O2 par une globine augmente l’affinité des autres globines pour l’O2 : il y a interaction coopérative entre globines et réaction en cascade accélérant la capture des dioxygènes.
Passage de la forme R à la forme T, tendue
Figure (2)
A l’approche d’une cellule à pH bas, les hélices alpha des globines se modifient, la cavité centrale s’agrandie, la position spatiale du Fe par rapport au plan de l’anneau de porphyrine change.
L’affinité de l’hémoglobine à l’oxygène diminue.
Changement de chargement
Figure (3)
L’oxygène est libéré et capté par la cellule qui en a besoin.
Le pH de la cellule réceptrice d’oxygène augmente ; l’hémoglobine se charge en CO2 et ions H+
Libération du CO2
Figure (4)
Le CO2 de la molécule, alors appelée déoxyhémoglobine, est libérée dans les alvéoles pulmonaires
Voir Système respiratoire.
L’hémoglobine reprend sa forme relaxée, lui permettant de se recharger en O2.
Notes :
- Le CO2 se connecte aux extrémités N-terminales
des globines et il est facilement libérable.
- L’ion H+ se lie à des résidus des chaînes protéiques.
- En présence de monoxyde de carbone
CO, l’hémoglobine se charge en CO.
Le CO se fixe sur le fer, et, avec une
affinité beaucoup plus élevée que l’O2, est
difficile à déloger = intoxication.
Page 12.
Modif post-traduction, accidentelles
Synthèse des protéines
Deux étapes
principales :
Transcription :
La
transcription de l’ADN en ARN messager se déroule dans le noyau des cellules
eucaryotes.
Traduction :
La « traduction » est le processus qui permet d’obtenir la protéine à partir des acides aminés et de l’information de séquençage contenu dans l’ARN.
La traduction a lieu dans le cytoplasme cellulaire.
Exemples de modifications
Il existe de très nombreuses modifications post-traductionnelles qui permettent la protéine définitive.
Parmi ces modifications, citons :
- Le clivage et réduction de la chaîne polypeptidique,