Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Fonction d’onde
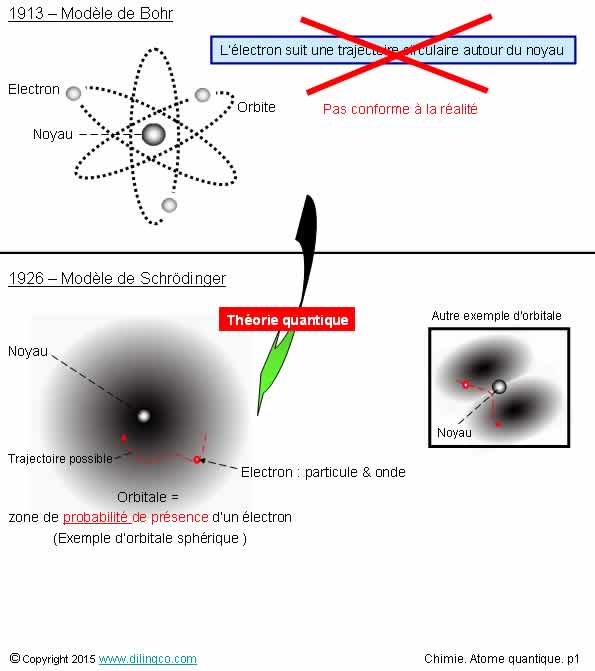
Sélectionner les deux affirmations exactes :
1- Fonctions & nombres quantiques : description des orbitales
(les positions probables des électrons), mais les énergies de ces électrons
2- Fonction d’onde : donne la position précise de l’électron
par rapport au noyau
3- Fonction d’onde : ne peut s’exprimer qu’en fonction de
l’espace (x,y,z) et du temps
4- Fonction d’onde : concept de la mécanique quantique qui,
appliqué à l’atome, décrit l’état du système noyau-électron
5- La répartition des électrons dans un atome ou une molécule est
liée à l’énergie (paramètres n, l, m) et au spin des électrons
Les affirmations 4 et 5 sont exactes.
Affirmation 1.
Non.
Les fonctions quantiques décrivent les orbitales des électrons et les niveaux
d’énergies.
Les valeurs des niveaux d’énergie :
- ne dépendent que de n, l, m (cas général),
- que de n, si un seul électron dans l’atome ; Atome d’hydrogène
et ions atomiques, les à un seul électron.
Ions atomiques à un seul électron = atome hydrogénoïdes
Affirmation 2
Non.
Il n’est pas possible de définir précisément la position d’un
électron.
La fonction d’onde permet d’estimer les zones de probabilité de présence de
l’électron.
Affirmation 3
Non.
Une fonction d’onde s’exprime plus généralement en fonction de
nombres quantiques, n, l, m, s.
Affirmation 5
Oui.
Répartition des électrons = configuration électronique.
La configuration
électronique d’un atome ou d’une molécule dépend de l’énergie des divers électrons et de leur spin.
Le spin est une propriété quantique des particules.
Pour l’électron, le spin peut prendre 2 états : ms= +1/2 ou ms=
-1/2
Le spin influence la répartition des électrons.
Voir page suivante « Principe de Pauli ».
Fonction
d’onde
La fonction d’onde « phi » décrit les caractéristiques
quantiques du système noyau-électron.
La fonction, définie par l’équation de
Schrödinger, ressemble aux fonctions
définissant les ondes, d’où le nom « fonction d’onde ».
L’équation est vérifiée :
- Pour
des valeurs quantifiées de l’énergie,
- Pour
des fonctions propres appelées « Orbitales atomiques ».
Orbitale
OA : Orbitale Atomique
=> modèle quantique de l’atome.
Une orbitale atomique est une zone de
l’espace où l’électron a une probabilité de
95% de se trouver.
La forme et la dimension d’une orbitale atomique,
OA, (sphères, double haltères, etc.),
dépend de nombres quantiques n, l, m.
Nombres
quantiques
Quatre nombres
quantiques :
- n, nombre quantique
principal,
- l, nombre quantique secondaire, peut prendre n'importe quelle
valeur entière dans l'intervalle [0 ; n-1].
- m, nombre
quantique magnétique peut prendre n'importe quelle valeur entière comprise dans
l'intervalle [ – l ; l ]
- s appelé Spin,
moment de spin (ms) est interprétable comme la rotation de
l’électron sur lui-même.
ms ne peut prendre que les valeurs – 1/2 ou 1/2 (états
parfois appelés up et down)
Les orbitales atomiques sont liées aux trois premiers
nombres quantiques n, L, m.
.
Page 2.
Types d’orbitales
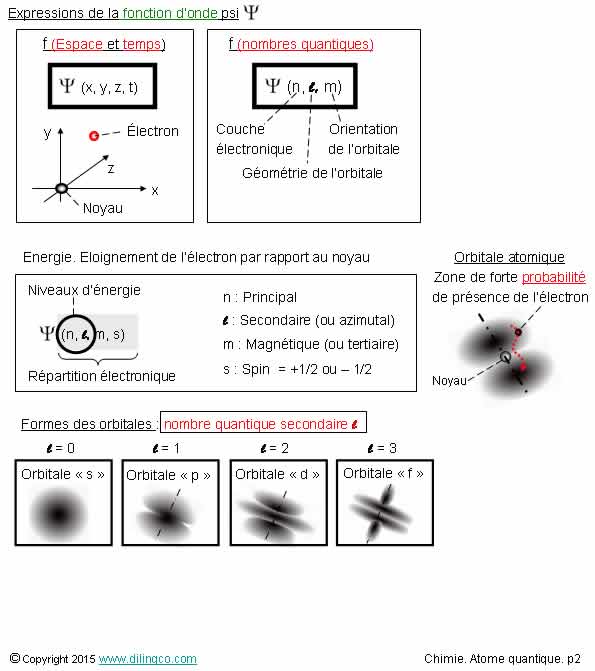
Sélectionner les deux affirmations exactes :
1- Toutes les orbitales d’un atome sont centrées sur le noyau
2- Les orbitales de type « f » existent pour des
électrons de nombre quantique n=3
3- 1 seul type d’orbitale s (sphérique), 3 types d’orbitales p, 5
types d’orbitales d, etc.
4- Les orbitales d et f ont le même nombre de sous-couches électroniques
que les orbitales p
5- Orbitale : trajectoire précise d’un électron
Les affirmations 1 et 3 sont exactes.
Affirmation 1
Oui.
Toutes les orbitales d’un atome sont centrées sur le noyau.
(La représentation linéaire de la figure répond simplement à un souci
de clarté)
Affirmation 2
Non.
Les orbitales de type « f » existent à partir des
électrons de nombre quantique n=4
Affirmation
3
Oui.
À se rappeler :
- l’ordre
des orbitales : s, p, d, f, g, h, …
- des sous-couches électroniques à partir des orbitales p,
- nombre
de sous-couches : rajouter 2 à chaque fois
que l’on progresse dans la liste p, d, f, g, h, …
Par
exemple, une orbitale de type p est composée de 3
doubles haltères superposées.
La position des électrons sur ces haltères dépend de leur nombre
quantique m
Les états qui ne diffèrent que par la valeur du nombre quantique
magnétique m ont la même énergie.
Les sous-couches électroniques sont dites appartenir à des niveaux d’énergie
dégénérés.
Affirmation 4
Non
Orbitale d : 5 sous-couches
(On dit aussi simplement « 5 orbitales d »)
Orbitale f : 7 sous-couches
Affirmation 5
Non.
Orbitale : zones d’évolution probable, à 95%, d’un électron.
Selon le type, les orbitales peuvent avoir des formes étranges.
Page 3.
Ordre des orbitales. Klechkowski
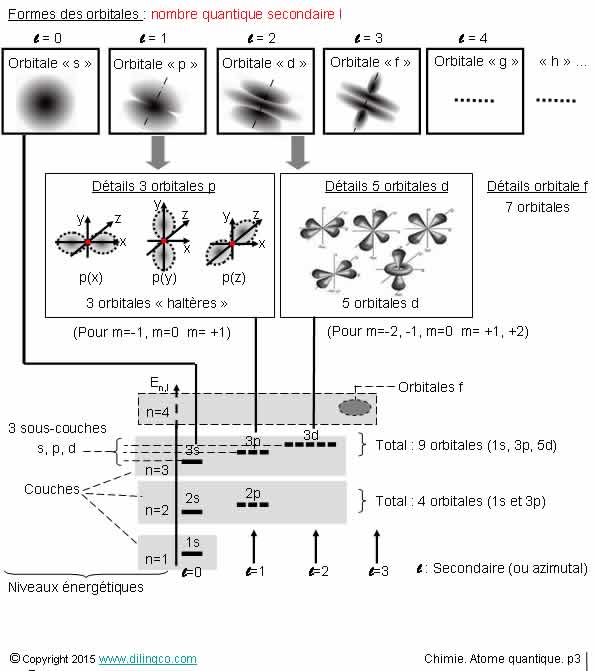
Sélectionner les deux affirmations exactes :
1- Les énergies augmentent avec la somme (n+L) des 2 premiers
nombres quantiques
2- [A] : n = niveau d’énergie
3- [B] : Les électrons (n=4, L=2) et (n=5, L=1) ont la même
énergie
4- [C] : 3s
5- Les orbitales d’un atome suivent une chronologie
spécifique : s, s, p, s, d, p, s … que le diagramme de Klechkowski permet de retrouver
Les affirmations 1 et 5 sont exactes.
Affirmation 1
Oui.
C’est la règle de Klechkowski :
- Les énergies augmentent en niveaux avec la somme (n+L) des deux
premiers nombres quantiques
- Pour les valeurs de la somme (n+L) égales, l’énergie la plus
basse correspond à la valeur n la plus basse.
Exemple de sommes égales :
(n=2, L=1) et (n=3, L=0)
L’électron (n=2, L=1) a l’énergie la plus basse.
Affirmation 2
Non.
[A] : n = nombre quantique principal n.
Affirmation 3
Non.
[B] : Les électrons (n=4, L=2) et (n=5, L=1) ont la même
somme n+L.
Pour les valeurs de n+L égales : énergie la plus basse =
électron de valeur n la plus basse.
Affirmation 4
Non.
[C] : 3d
Affirmation 5
Oui.
Se rappeler
- la chronologie des orbitales s, p, d, f, g, h
- la manière de construire le diagramme de Klechkowski :
n décroissant en ordonnée, L en abscisse, sens des diagonales
Page 4.
Représentation des énergies

Sélectionner les deux affirmations exactes :
1- Les sous-couches électroniques des orbitales p, d, f, g,… ont
des niveaux d’énergie différents
2- Energies des électrons : 2 premiers nombres quantiques (n,
L). Type : nombre quantique secondaire (L). Orientation : nombre
quantique magnétique m
3- [A] : 4f (Suivre la chronologie des orbitales sur le
diagramme de Klechkowski)
4- [B] : (n=3, L=2)
5- Il ne peut pas y avoir plusieurs sommes (n+L) égales
6- Orbitales f : 5 sous-couches électroniques
Les affirmations 2 et 4 sont exactes.
Affirmation 1
Non.
Les sous-couches d’une même OA sont sur un même niveau d’énergie.
Le troisième nombre quantique, m pour « magnétique », positionne l’électron
sur une sous-couche
électronique.
Orbitales p, d, f, g = sous-couches électroniques.
Affirmation 2
Oui.
Le type de l’orbitale dépend de L, deuxième nombre quantique.
[C] :
L = 0 : orbitale type s,
L = 1 : orbitale type p,
L = 2 : orbitale type d,
L = 3 : orbitale type f,
…
Les orientations des sous-couches dépendent du nombre quantique m.
[D] :
Orbitale
p :
L = 1, m
= -1,0,+1
(m plus
grand ou égal à –L, et plus petit ou égal à +m)
3
orbitales atomique p : px, py, pz
(Ou
sous-couches)
Orbitale
d :
L = 2, m
= -2,-1,0,1,2
5
orbitales d
Orbitale f :
L = 3, m
= -3,-2,-1,0,1,2,3
7 orbitales f.
Affirmation 3
Non.
[A] : 5p
Orbitale p : 3 sous-couches.
Toutes les sous-couches sont sur le même niveau d’énergie.
Les sous-couches électroniques sont dites appartenir à des niveaux d’énergie
dégénérés.
Affirmation 5
Si.
Voir figure « Valeurs égale de n+L »
L’énergie des
orbitales atomiques (OA), augmente lorsque
n+l augmente.
Pour les valeurs de la somme (n+L) égales, l’énergie la plus basse
correspond à la valeur n la plus basse.
Affirmation 6
Non.
Orbitale type p : 3 sous-couches électroniques
Orbitale type d : 5 sous-couches électroniques
Orbitale type f, L = 3, m = -3,-2,-1,0,1,2,3 : 7 sous-couches
électroniques
Orbitales type g : 9 sous-couches électroniques
(Ajouter 2 chaque fois)
Page 5.
Exclusions. Pauli &
Hund

Sélectionner les deux affirmations exactes :
1- Dans un atome, 2électrons peuvent avoir le même état quantique
(Mêmes n,L,m,s)
2- Maximum 2 électrons par case quantique. Les 2 électrons ont des
spins opposés
3- Remplissage d’un niveau d’énergie (si composé de sous-couches) :
mettre le maximum d’électrons en paires (1 paire par case quantique)
4- [C] : La répartition respecte le principe d’exclusion de Pauli
et la règle de Hund
5- [D] : Les 20 électrons du calcium sont tous regroupés en
paires de 2 électrons de spins opposés (spins antiparallèles)
Les affirmations 2 et 5 sont exactes.
Affirmation 1
Non.
Principe d’exclusion de Pauli
Tous les électrons d’un même atome ont des états quantiques
différents.
Affirmation 2
Oui.
Conséquence du principe d’exclusion de Pauli : Maximum 2 électrons
par case quantique et les 2 électrons ont un spin opposé.
(Maximum 2 électrons par orbitale « s » ou par sous-couche
électronique)
Affirmation 3
Non.
Règle de Hund : Pour le remplissage d’un niveau
d’énergie, répartir les électrons avec le maximum de spins parallèles, puis compléter les
cases quantiques de manière à obtenir des paires d’électrons (électrons de spins
opposés).
Affirmation 4
Non.
Dans l’exemple à 7 électrons, la répartition [C] :
- respecte le principe d’exclusion de Pauli (Max 2 électrons, et
de spins opposés,
- ne respecte pas la règle de Hund (Maximum de spins parallèles
pour la dernière orbitale. Ici orbitale p = 3 sous-couches.
[A] est la représentation correcte.
Page 6.
Electrons de valence

Sélectionner les deux affirmations exactes :
1- Électrons de valence : ceux de l’orbitale d’énergie la
plus élevée et ceux des orbitales plus faibles incomplètes
2- Électrons de valence : que pour le modèle de Bohr
3- [A]. L’atome de sodium : 2 électrons de valence
4- [B] : écriture simplifiée d’un atome de magnésium
5- [C] : l’atome de chlore a 7 électrons de valence et 10
électrons de cœur
6- [C] : l’atome de chlore a 35 électrons
Les affirmations 1 et 5 sont exactes.
Affirmation 3
Non.
[A]. L’atome de sodium : 1 électron de valence.
Affirmation 4
Non.
[B] : Atome à 11 électron => 11 protons = Z=11 = Atome de
sodium.
Mg, magnésium = 12 protons/électrons
Affirmation 5
Oui.
[C] : l’atome de chlore a 7 électrons de valence et 10
électrons de cœur
Affirmation 6
Non.
Le nucléon est un terme générique pour désigner un proton ou un neutron.
Pour un atome, charge totale nulle, le nombre d’électrons est égal au nombre de
protons.
Le nombre
atomique d’un atome est le nombre de protons de l’atome.
17 = 17
protons,
35 = 35 nucléons = 17 protons + 18 neutrons.
Electrons de valence :
Les électrons de valence sont ceux :
- De la couche n la plus élevée, et ceux,
- Des orbitales de plus faibles énergies incomplètes.
Les électrons de valence sont les moins liés au noyau.
Les électrons de valence permettent d’établir des liaisons avec d’autres
atomes pour former des molécules.
Représentation de Lewis
Les électrons de valence sont ceux de la représentation de Lewis où:
- Les électrons
célibataires sont représentés par des points,
- Une paire d’électrons est représentée par un tiret.
Electrons de cœur
Les électrons de cœur sont les électrons qui ne sont pas des
électrons de valence.
Page 7.
Inversion de couches

Sélectionner les deux affirmations exactes :
1- Les couches externes 4s &
3d ont des énergies voisines. Elles peuvent s’inverser en cas de variations
d’énergie
2- [A] : Sc, Scandium : 1 électrons de valence (sur
l’OA 4s)
3- [B] : 10 électrons de valence (sur la couche 3d)
4- Répartition électronique correcte de l’atome de Brome. 7
électrons de valence (sur les couches 4 s & 4p)
5- À partir de 4s, les couches externes s et d sont systématiquement
inversées
Les affirmations 1 et 4 sont exactes.
Affirmation 1
Oui.
La couche externe 3d a une énergie très légèrement supérieure à
4s.
Mais, si
la couche d a au moins un électron, et en cas de variation d’énergie, les couches 4s et 4d peuvent s’inverser.
Même chose pour les externes couches 5s, 6s, 7s, et, respectivement, 4d, 4f, 5f.
Affirmation 2
Non.
Il faut :
- appliquer la règle d’inversion,
- inclure dans les électrons de valence ceux des orbitales de plus faibles
énergies incomplètes.
Affirmation 5
Non.
Inversion des couches externes couches 4s, 5s, 6s, 7s avec les
couches supérieures d respectives que si la couche supérieure d possède au moins
un électron, et pour refléter la variabilité de l’énergie.
Exemple pour le Fer, Z=26 :
Au lieu d’écrire Fe : [Ar] 4s2 3d6
On écrit : Fe : [Ar] 3d6 4s2 pour montrer que les électrons
d’ionisation proviennent d’abord de l’orbitale s, et que les électrons
4s sont aussi des électrons de valence.
Ions du fer :
Fe+ : [Ar] 3d6
4s1
Fe2+ : [Ar] 3d6
Fe3+ : [Ar] 3d5
Fe4+ : [Ar] 3d4
Notes :
- Même chose pour tous les autres éléments possédant des électrons
3d,
- La notation relative à [Ar], Argon, 18 électrons, évite d’avoir
à spécifier les orbitales basses.
Rappel : Ar, Z=18
Electrons de valence :
Les électrons de valence sont ceux de la couche n la plus
élevée
et ceux des orbitales de plus
faibles énergies incomplètes.
Page 8.
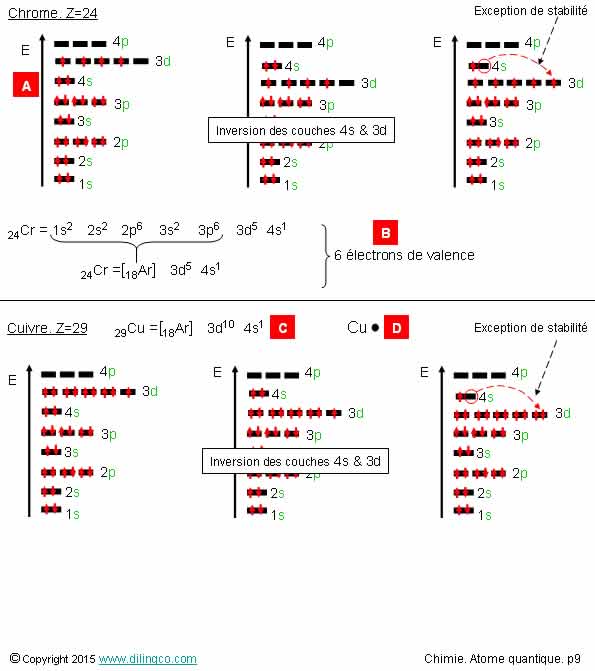
Exceptions. Chrome.
Cuivre

Sélectionner l’affirmation exacte :
1- [A] : Le chrome a 4 électrons de valence
2- [B] : Le chrome a 1 électron de valence
3- [C] : L’orbitale 3d est complète
4- [D] : La représentation de Lewis du cuivre est fausse
L’affirmation 3 est exacte.
Affirmation 1
Non.
[A]. Pour déterminer la configuration exacte :
- Appliquer la règle d’inversion couches s et d,
- Appliquer l’exception de stabilité du chrome : « La
couche
3d gagne un électron en provenance de la couche 4s.
Affirmation 2
Non.
[B] : Le chrome a 5 électron de valence.
Électrons de valence : ceux de la couche n la plus élevée et ceux des orbitales de plus
faibles énergies incomplètes.
Métaux
de transition
Certains
atomes présentent une exception de stabilité pour l’état fondamental : La couche 3d gagne un électron en provenance de
la couche 4s.
C’est le
cas, notamment des métaux de transition tels que le chrome,
le cuivre, l’argent, l’or.
Page 9.
Effet d’écran
Sélectionner l’affirmation exacte :
1- L’énergie
électronique d’un atome n’est pas liée à son nombre d’électrons
2-
L’attraction effective sur un électron est diminuée par la présence d’autres
électrons entre lui et le noyau
3- [A] :
Aucun électron ne possède cette énergie (-13,6 ev)
4-
L’énergie électronique d’un atome polyélectrons peut être définie très
exactement, sans approximation
L’affirmation
2 est exacte.
Affirmation
1
Si.
Dans la
formule, Z est le nombre de protons ou d’électrons.
Affirmation
2
Oui.
La charge
effective du noyau apparaît plus petite :
Zi* = Z - s
Zi*.e : charge effective
s
= constante d'écran
Note : L’énergie est à calculer pour chaque électron
de l’atome (indice i dans la formule).
Voir “Calcul de la charge effective. Règles de Slater” sur
Wikipédia.
Affirmation 3
Si.
[A] : La valeur -13,6 eV correspond
à l'état fondamental de l'hydrogène. n=1l’électron a son énergie la
plus basse.
-13,6 est la constante de Rydberg.
Affirmation
4
Non.
L’énergie
électronique globale d’un atome polyélectrons (la somme des énergies de chaque
électron), ne peut pas être définie précisément.
Des approximations permettent de résoudre l’équation
de Schrödinger dans le cas d’atomes multi-électrons.
L’effet
d’écran est une de ces approximations.
Voir sur Wikipédia:
- “Calcul de la charge effective. Règles de Slater”,.
- “Configuration électronique”.
Page 10.
Atomes hydrogénoïdes
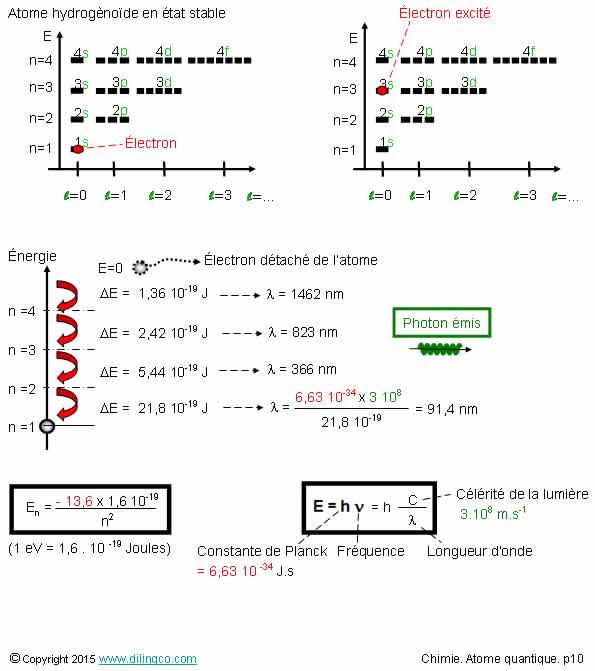
Sélectionner l’affirmation exacte :
1- Un seul électron : les valeurs des niveaux d’énergie
dépendent des trois premiers nombres quantiques
2- Les orbitales (n=2, L=0) et (n=2, L=1) n’ont pas la même
énergie
3- Un seul électron : il ne peut que se trouver sur l’orbite
1s
4- Une onde électromagnétique est aussi une émission quantifiée
d’énergie. Fréquence de l’onde et l’énergie émise reliées par la formule de
Planck
L’affirmation 4 est exacte.
Affirmation 1
Non.
Un seul électron : les valeurs des niveaux d’énergie ne dépendent
que du nombre quantique principal n.
Un seul
électron :
- atome d’hydrogène,
- atomes
hydrogénoïdes
Atomes hydrogénoïdes : ion monoatomique à un seul électron
(= Atome ionisés Z-1 fois).
Exemples : Hélium, Z=2, ionisé une fois. He+
Pour l’hydrogène et pour les atomes hydrogénoïdes, les valeurs
des niveaux d’énergie ne dépendent que du nombre quantique principal n.
Affirmation 2
Si.
Les orbitales (n=2, L=0) et (n=2, L=1) ont la même énergie.
(Voir figure)
Affirmation 3
Non.
L’électron en orbite 1s n’est pas excité = état stable de l’atome d’hydrogène
ou de l’atome hydrogénoïde.
Excité, l’électron se trouve sur une orbitale d’énergie
supérieure.
Affirmation 4
Oui.
Dualité onde-particule : les
rayonnements présentent des propriétés d'ondes et
de particules.
Onde :
possède une longueur d’onde (Inverse = fréquence).
Photons :
Particule d’énergie.
L’onde et
l’énergie sont reliées par la relation la relation
de Planck et sa constante h = 6,626×10-34
Joules par seconde.
Une onde électromagnétique est aussi une émission quantifiée
d’énergie (une particule), et inversement.
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Fonction d’onde

Sélectionner les deux affirmations exactes :
1- Fonctions & nombres quantiques : description des orbitales (les positions probables des électrons), mais les énergies de ces électrons
2- Fonction d’onde : donne la position précise de l’électron par rapport au noyau
3- Fonction d’onde : ne peut s’exprimer qu’en fonction de l’espace (x,y,z) et du temps
4- Fonction d’onde : concept de la mécanique quantique qui, appliqué à l’atome, décrit l’état du système noyau-électron
5- La répartition des électrons dans un atome ou une molécule est liée à l’énergie (paramètres n, l, m) et au spin des électrons
Les affirmations 4 et 5 sont exactes.
Affirmation 1.
Non.
Les fonctions quantiques décrivent les orbitales des électrons et les niveaux d’énergies.
Les valeurs des niveaux d’énergie :
- ne dépendent que de n, l, m (cas général),
- que de n, si un seul électron dans l’atome ; Atome d’hydrogène et ions atomiques, les à un seul électron.
Ions atomiques à un seul électron = atome hydrogénoïdes
Affirmation 2
Non.
Il n’est pas possible de définir précisément la position d’un électron.
La fonction d’onde permet d’estimer les zones de probabilité de présence de l’électron.
Affirmation 3
Non.
Une fonction d’onde s’exprime plus généralement en fonction de nombres quantiques, n, l, m, s.
Affirmation 5
Oui.
Répartition des électrons = configuration électronique.
La configuration
électronique d’un atome ou d’une molécule dépend de l’énergie des divers électrons et de leur spin.
Le spin est une propriété quantique des particules.
Pour l’électron, le spin peut prendre 2 états : ms= +1/2 ou ms=
-1/2
Le spin influence la répartition des électrons.
Voir page suivante « Principe de Pauli ».
Fonction d’onde
La fonction d’onde « phi » décrit les caractéristiques
quantiques du système noyau-électron.
La fonction, définie par l’équation de
Schrödinger, ressemble aux fonctions
définissant les ondes, d’où le nom « fonction d’onde ».
L’équation est vérifiée :
- Pour des valeurs quantifiées de l’énergie,
- Pour des fonctions propres appelées « Orbitales atomiques ».
Orbitale
OA : Orbitale Atomique => modèle quantique de l’atome.
Une orbitale atomique est une zone de l’espace où l’électron a une probabilité de 95% de se trouver.
La forme et la dimension d’une orbitale atomique, OA, (sphères, double haltères, etc.), dépend de nombres quantiques n, l, m.
Nombres quantiques
Quatre nombres quantiques :
- n, nombre quantique principal,
- l, nombre quantique secondaire, peut prendre n'importe quelle
valeur entière dans l'intervalle [0 ; n-1].
- m, nombre
quantique magnétique peut prendre n'importe quelle valeur entière comprise dans
l'intervalle [ – l ; l ]
- s appelé Spin,
moment de spin (ms) est interprétable comme la rotation de
l’électron sur lui-même.
ms ne peut prendre que les valeurs – 1/2 ou 1/2 (états
parfois appelés up et down)
Les orbitales atomiques sont liées aux trois premiers
nombres quantiques n, L, m.
.
Page 2.
Types d’orbitales

Sélectionner les deux affirmations exactes :
1- Toutes les orbitales d’un atome sont centrées sur le noyau
2- Les orbitales de type « f » existent pour des électrons de nombre quantique n=3
3- 1 seul type d’orbitale s (sphérique), 3 types d’orbitales p, 5 types d’orbitales d, etc.
4- Les orbitales d et f ont le même nombre de sous-couches électroniques que les orbitales p
5- Orbitale : trajectoire précise d’un électron
Les affirmations 1 et 3 sont exactes.
Affirmation 1
Oui.
Toutes les orbitales d’un atome sont centrées sur le noyau.
(La représentation linéaire de la figure répond simplement à un souci de clarté)
Affirmation 2
Non.
Les orbitales de type « f » existent à partir des électrons de nombre quantique n=4
Affirmation 3
Oui.
À se rappeler :
- l’ordre des orbitales : s, p, d, f, g, h, …
- des sous-couches électroniques à partir des orbitales p,
- nombre de sous-couches : rajouter 2 à chaque fois que l’on progresse dans la liste p, d, f, g, h, …
Par exemple, une orbitale de type p est composée de 3 doubles haltères superposées.
La position des électrons sur ces haltères dépend de leur nombre quantique m
Les états qui ne diffèrent que par la valeur du nombre quantique magnétique m ont la même énergie.
Les sous-couches électroniques sont dites appartenir à des niveaux d’énergie dégénérés.
Affirmation 4
Non
Orbitale d : 5 sous-couches
(On dit aussi simplement « 5 orbitales d »)
Orbitale f : 7 sous-couches
Affirmation 5
Non.
Orbitale : zones d’évolution probable, à 95%, d’un électron.
Selon le type, les orbitales peuvent avoir des formes étranges.
Page 3.
Ordre des orbitales. Klechkowski

Sélectionner les deux affirmations exactes :
1- Les énergies augmentent avec la somme (n+L) des 2 premiers nombres quantiques
2- [A] : n = niveau d’énergie
3- [B] : Les électrons (n=4, L=2) et (n=5, L=1) ont la même énergie
4- [C] : 3s
5- Les orbitales d’un atome suivent une chronologie spécifique : s, s, p, s, d, p, s … que le diagramme de Klechkowski permet de retrouver
Les affirmations 1 et 5 sont exactes.
Affirmation 1
Oui.
C’est la règle de Klechkowski :
- Les énergies augmentent en niveaux avec la somme (n+L) des deux premiers nombres quantiques
- Pour les valeurs de la somme (n+L) égales, l’énergie la plus basse correspond à la valeur n la plus basse.
Exemple de sommes égales :
(n=2, L=1) et (n=3, L=0)
L’électron (n=2, L=1) a l’énergie la plus basse.
Affirmation 2
Non.
[A] : n = nombre quantique principal n.
Affirmation 3
Non.
[B] : Les électrons (n=4, L=2) et (n=5, L=1) ont la même somme n+L.
Pour les valeurs de n+L égales : énergie la plus basse = électron de valeur n la plus basse.
Affirmation 4
Non.
[C] : 3d
Affirmation 5
Oui.
Se rappeler
- la chronologie des orbitales s, p, d, f, g, h
- la manière de construire le diagramme de Klechkowski :
n décroissant en ordonnée, L en abscisse, sens des diagonales
Page 4.
Représentation des énergies

Sélectionner les deux affirmations exactes :
1- Les sous-couches électroniques des orbitales p, d, f, g,… ont des niveaux d’énergie différents
2- Energies des électrons : 2 premiers nombres quantiques (n, L). Type : nombre quantique secondaire (L). Orientation : nombre quantique magnétique m
3- [A] : 4f (Suivre la chronologie des orbitales sur le diagramme de Klechkowski)
4- [B] : (n=3, L=2)
5- Il ne peut pas y avoir plusieurs sommes (n+L) égales
6- Orbitales f : 5 sous-couches électroniques
Les affirmations 2 et 4 sont exactes.
Affirmation 1
Non.
Les sous-couches d’une même OA sont sur un même niveau d’énergie.
Le troisième nombre quantique, m pour « magnétique », positionne l’électron sur une sous-couche électronique.
Orbitales p, d, f, g = sous-couches électroniques.
Affirmation 2
Oui.
Le type de l’orbitale dépend de L, deuxième nombre quantique.
[C] :
L = 0 : orbitale type s,
L = 1 : orbitale type p,
L = 2 : orbitale type d,
L = 3 : orbitale type f,
…
Les orientations des sous-couches dépendent du nombre quantique m.
[D] :
Orbitale p :
L = 1, m = -1,0,+1
(m plus grand ou égal à –L, et plus petit ou égal à +m)
3 orbitales atomique p : px, py, pz
(Ou sous-couches)
Orbitale d :
L = 2, m = -2,-1,0,1,2
5 orbitales d
Orbitale f :
L = 3, m = -3,-2,-1,0,1,2,3
7 orbitales f.
Affirmation 3
Non.
[A] : 5p
Orbitale p : 3 sous-couches.
Toutes les sous-couches sont sur le même niveau d’énergie.
Les sous-couches électroniques sont dites appartenir à des niveaux d’énergie dégénérés.
Affirmation 5
Si.
Voir figure « Valeurs égale de n+L »
L’énergie des orbitales atomiques (OA), augmente lorsque n+l augmente.
Pour les valeurs de la somme (n+L) égales, l’énergie la plus basse correspond à la valeur n la plus basse.
Affirmation 6
Non.
Orbitale type p : 3 sous-couches électroniques
Orbitale type d : 5 sous-couches électroniques
Orbitale type f, L = 3, m = -3,-2,-1,0,1,2,3 : 7 sous-couches électroniques
Orbitales type g : 9 sous-couches électroniques
(Ajouter 2 chaque fois)
Page 5.
Exclusions. Pauli & Hund

Sélectionner les deux affirmations exactes :
1- Dans un atome, 2électrons peuvent avoir le même état quantique (Mêmes n,L,m,s)
2- Maximum 2 électrons par case quantique. Les 2 électrons ont des spins opposés
3- Remplissage d’un niveau d’énergie (si composé de sous-couches) : mettre le maximum d’électrons en paires (1 paire par case quantique)
4- [C] : La répartition respecte le principe d’exclusion de Pauli et la règle de Hund
5- [D] : Les 20 électrons du calcium sont tous regroupés en paires de 2 électrons de spins opposés (spins antiparallèles)
Les affirmations 2 et 5 sont exactes.
Affirmation 1
Non.
Principe d’exclusion de Pauli
Tous les électrons d’un même atome ont des états quantiques différents.
Affirmation 2
Oui.
Conséquence du principe d’exclusion de Pauli : Maximum 2 électrons par case quantique et les 2 électrons ont un spin opposé.
(Maximum 2 électrons par orbitale « s » ou par sous-couche électronique)
Affirmation 3
Non.
Règle de Hund : Pour le remplissage d’un niveau d’énergie, répartir les électrons avec le maximum de spins parallèles, puis compléter les cases quantiques de manière à obtenir des paires d’électrons (électrons de spins opposés).
Affirmation 4
Non.
Dans l’exemple à 7 électrons, la répartition [C] :
- respecte le principe d’exclusion de Pauli (Max 2 électrons, et de spins opposés,
- ne respecte pas la règle de Hund (Maximum de spins parallèles pour la dernière orbitale. Ici orbitale p = 3 sous-couches.
[A] est la représentation correcte.
Page 6.
Electrons de valence

Sélectionner les deux affirmations exactes :
1- Électrons de valence : ceux de l’orbitale d’énergie la plus élevée et ceux des orbitales plus faibles incomplètes
2- Électrons de valence : que pour le modèle de Bohr
3- [A]. L’atome de sodium : 2 électrons de valence
4- [B] : écriture simplifiée d’un atome de magnésium
5- [C] : l’atome de chlore a 7 électrons de valence et 10 électrons de cœur
6- [C] : l’atome de chlore a 35 électrons
Les affirmations 1 et 5 sont exactes.
Affirmation 3
Non.
[A]. L’atome de sodium : 1 électron de valence.
Affirmation 4
Non.
[B] : Atome à 11 électron => 11 protons = Z=11 = Atome de sodium.
Mg, magnésium = 12 protons/électrons
Affirmation 5
Oui.
[C] : l’atome de chlore a 7 électrons de valence et 10 électrons de cœur
Affirmation 6
Non.
Le nucléon est un terme générique pour désigner un proton ou un neutron.
Pour un atome, charge totale nulle, le nombre d’électrons est égal au nombre de
protons.
Le nombre atomique d’un atome est le nombre de protons de l’atome.
17 = 17
protons,
35 = 35 nucléons = 17 protons + 18 neutrons.
Electrons de valence :
Les électrons de valence sont ceux :
- De la couche n la plus élevée, et ceux,
- Des orbitales de plus faibles énergies incomplètes.
Les électrons de valence sont les moins liés au noyau.
Les électrons de valence permettent d’établir des liaisons avec d’autres atomes pour former des molécules.
Représentation de Lewis
Les électrons de valence sont ceux de la représentation de Lewis où:
- Les électrons
célibataires sont représentés par des points,
- Une paire d’électrons est représentée par un tiret.
Electrons de cœur
Les électrons de cœur sont les électrons qui ne sont pas des électrons de valence.
Page 7.
Inversion de couches

Sélectionner les deux affirmations exactes :
1- Les couches externes 4s & 3d ont des énergies voisines. Elles peuvent s’inverser en cas de variations d’énergie
2- [A] : Sc, Scandium : 1 électrons de valence (sur l’OA 4s)
3- [B] : 10 électrons de valence (sur la couche 3d)
4- Répartition électronique correcte de l’atome de Brome. 7 électrons de valence (sur les couches 4 s & 4p)
5- À partir de 4s, les couches externes s et d sont systématiquement inversées
Les affirmations 1 et 4 sont exactes.
Affirmation 1
Oui.
La couche externe 3d a une énergie très légèrement supérieure à 4s.
Mais, si la couche d a au moins un électron, et en cas de variation d’énergie, les couches 4s et 4d peuvent s’inverser.
Même chose pour les externes couches 5s, 6s, 7s, et, respectivement, 4d, 4f, 5f.
Affirmation 2
Non.
Il faut :
- appliquer la règle d’inversion,
- inclure dans les électrons de valence ceux des orbitales de plus faibles énergies incomplètes.
Affirmation 5
Non.
Inversion des couches externes couches 4s, 5s, 6s, 7s avec les couches supérieures d respectives que si la couche supérieure d possède au moins un électron, et pour refléter la variabilité de l’énergie.
Exemple pour le Fer, Z=26 :
Au lieu d’écrire Fe : [Ar] 4s2 3d6
On écrit : Fe : [Ar] 3d6 4s2 pour montrer que les électrons d’ionisation proviennent d’abord de l’orbitale s, et que les électrons 4s sont aussi des électrons de valence.
Ions du fer :
Fe+ : [Ar] 3d6 4s1
Fe2+ : [Ar] 3d6
Fe3+ : [Ar] 3d5
Fe4+ : [Ar] 3d4
Notes :
- Même chose pour tous les autres éléments possédant des électrons 3d,
- La notation relative à [Ar], Argon, 18 électrons, évite d’avoir à spécifier les orbitales basses.
Rappel : Ar, Z=18
Electrons de valence :
Les électrons de valence sont ceux de la couche n la plus élevée et ceux des orbitales de plus faibles énergies incomplètes.
Page 8.
Exceptions. Chrome. Cuivre

Sélectionner l’affirmation exacte :
1- [A] : Le chrome a 4 électrons de valence
2- [B] : Le chrome a 1 électron de valence
3- [C] : L’orbitale 3d est complète
4- [D] : La représentation de Lewis du cuivre est fausse
L’affirmation 3 est exacte.
Affirmation 1
Non.
[A]. Pour déterminer la configuration exacte :
- Appliquer la règle d’inversion couches s et d,
- Appliquer l’exception de stabilité du chrome : « La couche 3d gagne un électron en provenance de la couche 4s.
Affirmation 2
Non.
[B] : Le chrome a 5 électron de valence.
Électrons de valence : ceux de la couche n la plus élevée et ceux des orbitales de plus faibles énergies incomplètes.
Métaux de transition
Certains atomes présentent une exception de stabilité pour l’état fondamental : La couche 3d gagne un électron en provenance de la couche 4s.
C’est le cas, notamment des métaux de transition tels que le chrome, le cuivre, l’argent, l’or.
Page 9.
Effet d’écran

Sélectionner l’affirmation exacte :
1- L’énergie électronique d’un atome n’est pas liée à son nombre d’électrons
2- L’attraction effective sur un électron est diminuée par la présence d’autres électrons entre lui et le noyau
3- [A] : Aucun électron ne possède cette énergie (-13,6 ev)
4- L’énergie électronique d’un atome polyélectrons peut être définie très exactement, sans approximation
L’affirmation 2 est exacte.
Affirmation 1
Si.
Dans la formule, Z est le nombre de protons ou d’électrons.
Affirmation 2
Oui.
La charge effective du noyau apparaît plus petite :
Zi* = Z - s
Zi*.e : charge effective
s = constante d'écran
Note : L’énergie est à calculer pour chaque électron de l’atome (indice i dans la formule).
Voir “Calcul de la charge effective. Règles de Slater” sur Wikipédia.
Affirmation 3
Si.
[A] : La valeur -13,6 eV correspond à l'état fondamental de l'hydrogène. n=1l’électron a son énergie la plus basse.
-13,6 est la constante de Rydberg.
Affirmation 4
Non.
L’énergie électronique globale d’un atome polyélectrons (la somme des énergies de chaque électron), ne peut pas être définie précisément.
Des approximations permettent de résoudre l’équation de Schrödinger dans le cas d’atomes multi-électrons.
L’effet d’écran est une de ces approximations.
Voir sur Wikipédia:
- “Calcul de la charge effective. Règles de Slater”,.
- “Configuration électronique”.
Page 10.
Atomes hydrogénoïdes

Sélectionner l’affirmation exacte :
1- Un seul électron : les valeurs des niveaux d’énergie dépendent des trois premiers nombres quantiques
2- Les orbitales (n=2, L=0) et (n=2, L=1) n’ont pas la même énergie
3- Un seul électron : il ne peut que se trouver sur l’orbite 1s
4- Une onde électromagnétique est aussi une émission quantifiée d’énergie. Fréquence de l’onde et l’énergie émise reliées par la formule de Planck
L’affirmation 4 est exacte.
Affirmation 1
Non.
Un seul électron : les valeurs des niveaux d’énergie ne dépendent que du nombre quantique principal n.
Un seul électron :
- atome d’hydrogène,
- atomes hydrogénoïdes
Atomes hydrogénoïdes : ion monoatomique à un seul électron
(= Atome ionisés Z-1 fois).
Exemples : Hélium, Z=2, ionisé une fois. He+
Pour l’hydrogène et pour les atomes hydrogénoïdes, les valeurs des niveaux d’énergie ne dépendent que du nombre quantique principal n.
Affirmation 2
Si.
Les orbitales (n=2, L=0) et (n=2, L=1) ont la même énergie.
(Voir figure)
Affirmation 3
Non.
L’électron en orbite 1s n’est pas excité = état stable de l’atome d’hydrogène ou de l’atome hydrogénoïde.
Excité, l’électron se trouve sur une orbitale d’énergie supérieure.
Affirmation 4
Oui.
Dualité onde-particule : les rayonnements présentent des propriétés d'ondes et de particules.
Onde : possède une longueur d’onde (Inverse = fréquence).
Photons : Particule d’énergie.
L’onde et l’énergie sont reliées par la relation la relation de Planck et sa constante h = 6,626×10-34 Joules par seconde.
Une onde électromagnétique est aussi une émission quantifiée d’énergie (une particule), et inversement.