Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Nombre d’oxydation

Sélectionner
l’affirmation exacte :
1-
Calculer le nombre d’oxydation est indispensable pour équilibrer une réaction
d’oxydoréduction
2- Le
nombre d’oxydation (n.o.) est la charge électrique réelle ou fictive d’un
élément chimique
3- Le
nombre d’oxydation d’un ion est nul
4- Le
nombre d’oxydation d’une molécule est différent de 0
L’affirmation
2 est exacte.
Affirmation
1
Non.
2 méthodes sont à disposition pour équilibrer une
réaction d’oxydoréduction.
Les 2
méthodes donnent le même résultat.
Utiliser
le n.o. pour équilibrer une réaction d’oxydoréduction n’est donc pas
indispensable.
Mais,
dans une équation chimique, une variation du
nombre d’oxydation indique à coup sûr qu’il s’agit d’une réaction d’oxydation.
Le n.o.
permet aussi de déterminer l’élément qui s’oxyde.
(élément qui s’oxyde = réducteur)
Affirmation
2
Oui.
Le nombre d’oxydation (n.o.) :
- aussi
appelé « degré d’oxydation », d.o.
- se note
conventionnellement en chiffres romains,
- est la charge électrique réelle ou fictive d’un élément
chimique,
- peut
apparaître dans les annotations:
Oxyde de
fer (II) : FeO, le fer a un n.o. = II
Oxyde de
fer (III) : Fe2O3, le fer a un n.o. = III
Ces
exemples montrent qu’un même atome peut avoir plusieurs valeurs de n.o. selon
la molécule où il se trouve.
Affirmation
3
Non.
Le nombre d’oxydation d’un ion est égal à sa charge électrique.
Exemples :
Cr3+,
n.o. = III
CIO4-,
n.o. = I
Affirmation
4
Non.
Une
molécule n’a pas de charge électrique : Le
nombre d’oxydation d’une molécule est nul.
Page 2.
Calcul du
n.o. Atomes O & H

Sélectionner
les deux affirmations exactes :
1- [A]. La
somme algébrique des n.o. des atomes d’une molécule est nulle
2- [A]. La
somme algébrique des n.o. des atomes d’un ion est nulle
3- [B]. Sauf
exceptions, n.o. de l’oxygène dans les composés oxygénés est égal à –II
4- Sauf
exceptions, n.o. de l’hydrogène dans les composés hydrogénés est égal à –II
5-
Hypothèse pour déterminer le nombre d’oxydation des éléments d’une
molécule : toutes les liaisons sont des liaisons covalentes
6- Nombre
d’oxydation du fluor = 0
Les
affirmations 1 et 3 sont exactes.
Se rappeler :
n.o. molécule = 0
n.o. ion = charge de l’ion
Affirmation
1
Oui.
[A]. Le n.o. d’une molécule est nul.
La charge globale d’une molécule est nulle : La somme algébrique des n.o des
atomes d’une molécule est nulle.
Exemples :
n.o.
H2O = 0 = 2H (+I)
+ O ( -II)
n.o.
H2, CH4, NaCl, H2SO4, CH3COOH,
… = 0
Affirmation 4
Non.
[A]. Le nombre d’oxydation d’un ion est égal à la charge de
l’ion.
Affirmation
3
Oui.
[B]. Composés
oxygénés :
Le n.o. de l’atome d’oxygène est égal à –II
Exceptions :
-
les peroxydes (H2O2,
Na2O2, K2O2, …), n.o. = -I.
- le
dioxygène O2, n.o. = 0
Règle à savoir par cœur
(Mnémotechnique : se rappeler le cas de la molécule d’eau).
Affirmation
4
Non.
[B]. Composés
hydrogénés :
Le n.o. de l’atome d’hydrogène est égal à +I.
n.o =+I car les atomes d’hydrogène, moins
électronégatifs, cèdent leur e- aux atomes liés d’électronégativité plus
élevée.
Exceptions :
- les hydrures, H combiné à un métal (NaH, LiH, KH,
…), n.o. = -I
- le
dihydrogène H2, n.o. = 0
Règle à savoir par cœur.
(Mnémotechnique : se rappeler le cas de la molécule d’eau).
Affirmation
5
Non.
Le nombre
d’oxydation (appelé aussi degré d’oxydation) = charge électrique
supplémentaire que porterait un atome si toutes les liaisons de la molécule
étaient des liaisons ioniques.
Dans une
liaison ionique, l’atome le plus électronégatif attire l’électron de l’atome le
moins électronégatif.
Exemple
figure, molécule d’eau : O attire les 2 électrons des atomes d’hydrogène,
son électronégativité est de -2
2
électrons de plus = -II
Hydrogène :
1 électron de moins = +I
Affirmation
6
Non.
Nombre
d’oxydation du fluor = -1
(Toujours)
Page 3.
n.o. des éléments chimiques
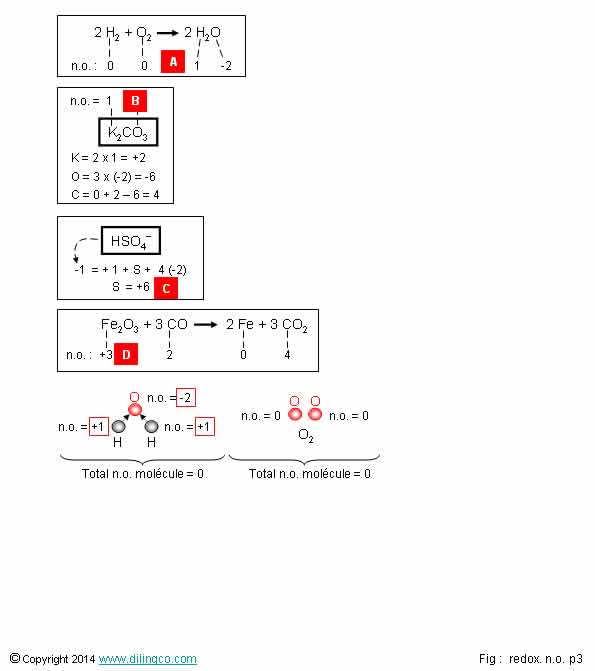
Sélectionner
l’affirmation exacte :
1- [A].
La réaction n’est pas une réaction d’oxydoréduction
2- [B].
Atome d’oxygène n.o. = -6
3- [C].
Nombre d’oxydation de l’atome de soufre = +6
4- [D].
CO est l’oxydant
L’affirmation
3 est exacte.
Une oxydation est une augmentation du n.o. du réducteur.
Une réduction est une diminution du n.o. de l’oxydant.
Affirmation
1
Si.
[A]. La
réaction est une réaction d’oxydoréduction :
les nombres d’oxydation changent de part et d’autre de l’équation.
L’hydrogène
a perdu un électron (n.o. augmente).
C’est le
réducteur (réducteur « rend »), il s’est oxydé.
L’oxygène
a gagné 2 électrons (n.o. diminue de 2 charges)
Affirmation
2
Non.
[B]. Atome d’oxygène n.o. = -2
Dans les
composés oxygénés, le n.o. de l’atome d’oxygène
est égal à –II.
Exceptions :
- les peroxydes (H2O2,
Na2O2, K2O2, …), n.o. = -I.
- le
dioxygène O2, n.o. = 0
Règle à savoir par cœur
(Mnémotechnique : se rappeler le cas de la molécule d’eau).
Affirmation
4
Non.
CO est le
réducteur.
Pour déterminer dans les réactifs quel est l’oxydant et quel est
le réducteur, il faut trouver les n.o. et déterminer leurs évolutions.
C passe
de +2 à gauche à +4 à droite : il a rendu 2 charges e-.
CO qui le contient est donc le réducteur ; réducteur « rend ».
Fe passe
de +3 à gauche à 0 à droite (corps simple) : il a gagné des charges e-.
Fe2O3 qui le contient est donc l’oxydant.
n.o. Fe,
à gauche, à calculer : 0=2(Fe) + 3(-2)
Page 4.
n.o. par représentations
de Lewis

Sélectionner
l’affirmation exacte :
1- [A]. 8
électrons de valence et 6 électrons de charge fictive : différence = 2. N.o.
de l’atome O = -2 dans la molécule de dioxygène
2- N.o de
l’atome d’oxygène dans l’eau oxygénée = -I
3- [B].
Sauf exception, le nombre d’oxydation d’un atome d’oxygène = -I
4- La
charge formelle d’un ion est toujours portée par un des atomes
L’affirmation
2 est exacte.
Affirmation
1
Non.
[A]. 6 électrons
de valence et non 8.
Seuls les
électrons de la couche externe sont à prendre en compte pour déterminer les
électrons de valence.
N.o. de
l’atome d’oxygène = 0 :
(6 charge
fictives – 6 électrons de valence = 0)
Affirmation
2
Oui.
L’eau oxygénée (ou peroxyde d’hydrogène) H2O2
est un peroxyde
n.o de l’atome d’oxygène dans les peroxydes = -I
(Voir figure)
no de l’atome d’oxygène dans le dioxygène = 0.
Les propriétés oxydantes fortes de l’eau oxygénée en font un
antiseptique et un stérilisant.
Affirmation
3
Non.
Composés
oxygénés : le n.o. de l’atome d’oxygène est
égal à –II
Exceptions :
- les peroxydes (H2O2, Na2O2,
K2O2, …), n.o. = -I.
- le
dioxygène O2, n.o. = 0
Règle à savoir par cœur
(Mnémotechnique : se rappeler le cas de la molécule d’eau).
Affirmation
4
Non.
La charge
formelle d’un ion n’est pas toujours assignée à un de ses atomes.
Exemple figure
: les 2 charges négatives de l’ion thiosulfate résultent de la somme algébrique
des charges formelles ; elles sont délocalisées.
Règles
de calcul du nombre d’oxydation
- Nombre d’oxydation d’un atome dans un composé chimique = charge fictive de l’atome si toutes les liaisons
étaient des liaisons ioniques.
- Liaisons
ioniques : tous les doublets sont attirés par
l’atome le plus électronégatif.
- Si les
2 atomes d’une liaison ionique ont la même
électronégativité, ils se partagent le doublet (1 électron attiré
par chacun des 2 atomes).
Nombre d’oxydation = électrons de valence - charge fictive
Si la différence est nulle, n.o. de l’atome dans la
molécule =0
Page 5.
n.o. fractionnaires ou
erronés

Sélectionner
l’affirmation exacte :
1- n.o.
des atomes = 0 dans : Cu, Fe, N2, Br2, P4, …, et H2, et O2, O3
2- On ne
peut pas trouver par calcul un nombre d’oxydation fractionnaire
3- [A].
Le n.o calculé du soufre (n.o. = +2) correspond à la réalité
4- [B].
Dans H2O, les n.o. des atomes d’hydrogène et d’oxygène sont nuls
L’affirmation
1 est exacte.
Affirmation
1
Oui.
Atomes de corps simples, n.o.= 0 :
-
Cu, Fe, N2, Br2, P4, …,
- H2, O2, O3
… et n.o H=+1 dans les composés hydrogénés sauf les hydrures
métalliques (où n.o. H=-1) NaH, CaH2,
...
… et n.o. O= -2 dans les
composés oxygénés sauf les peroxydes (H2O2, …,
O22-) où le n.o.= -1
… et n.o.
du fluor = -1 (il est l’élément le plus
électronégatif du tableau périodique).
Le n.o. de l’atome d’oxygène peut être égal à 0, -1, -2
Le n.o. de l’atome d’hydrogène peut être égal à 0, +1, -1
Affirmation
2
Si.
Exemple
Pb dans Pb3O4, n.o. Pb= 8/3
Le n.o
fractionnaire obtenu correspond à la moyenne de plombs oxydés à plusieurs
degrés.
Affirmation
3
Non. [A].
Dans
l’ion thiosulfate S2O32−, un atome de
soufre à :
- un n.o.
= +5
- un n.o.
= -1
- pas de
soufre avec n.o.=+2
Le n.o
calculé du soufre (n.o. = +2) ne correspond pas à la réalité.
Pour des structures complexes, la méthode de la représentation de Lewis pour
trouver le n.o. est plus sûre que le simple calcul.
Note :
L’ion thiosulfate se « dismute » : il apparaît dans 2 couples
redox différents et joue le rôles de réducteur ou d’oxydant selon les cas.
-
S2O32− (aq) / S (s)
-
SO2 (aq) / S2O32−(aq)
Affirmation
4
Non.
[B]. Dans
H2O :
- n.o.
des atomes d’hydrogène = +I
- n.o.
des atomes d’oxygène = -II
L’atome d’oxygène plus électronégatif que les atomes d’hydrogène
attire l’atome de chacun.
A se rappeler les n.o. dans H2O
Page 6.
Résumé. n.o. Oxydation et
réduction

Sélectionner
l’affirmation exacte :
1- [A].
L’atome de carbone est l’oxydant
2- [B].
Oxydation = perte d’électron par le réducteur
3- [C]. Formaldehyde
et acide formique : nombre d’oxydation du carbone = 2
4- Acide
formique = formaldéide réduit
L’affirmation
2 est exacte.
Affirmation
1
Non.
[A].
L’atome de carbone perd (« rend ») des électrons, il est le réducteur.
Affirmation
3
Non.
[C].
Formaldehyde :
0 = (-2)
+ C + 2 (+1)
(n.o.
molécule = n.o. oxygène + n.o. carbone + n.o hydrogènes)
N.o. carbone = 0
En représentation
topologique, l’atome de carbone, à l’interception ou à l’angle de 2 traits,
n’est pas mentionné.
Acide
formique :
0=
2(-2) + C + 2(+1)
N.o. carbone = +2
Affirmation
4
Non.
L’atome
de carbone dans l’acide formique a un nombre d’oxydation plus positif que celui
de l’atome de carbone dans le formaldéide : il a perdu des électrons.
Il s’agit
d’une oxydation = perte d’électron par le
réducteur.
Acide
formique = formaldéide oxydé.
Page 7.
Résumé. n.o.

Sélectionner
l’affirmation exacte :
1- [A].
N.o. atome d’oxygène dans un élément chimique = -I
2- [B].
N.o. atome chlore = +VIII
3- [C].
N.o. atome d’azote = +III
4-
Oxydation de l’azote. L’azote est le réducteur. Il s’est oxydé en rendant des
charges. Accroissement du n.o. par perte d’électrons
L’affirmation
4 est exacte.
Affirmation
2
Non.
Ne pas
oublier la charge négative de l’ion.
Affirmation
3
Oui.
0= N +
3(+1)
N.O.
azote = -III
Affirmation
4
Oui.
Une oxydation est une augmentation du n.o. du réducteur.
Une réduction est une diminution du n.o. de l’oxydant.
Règle à savoir par cœur
(Mnémotechnique : se rappeler le cas de la molécule d’eau).
Composés
oxygénés :
Le n.o. de l’atome d’oxygène est égal à –II
Exceptions :
-
les peroxydes (H2O2,
Na2O2, K2O2, …), n.o. = -I.
- le
dioxygène O2, n.o. = 0
Composés
hydrogénés :
Le n.o. de l’atome d’hydrogène est égal à +I.
n.o =+I car les atomes d’hydrogène, moins
électronégatifs, cèdent leur e- aux atomes liés d’électronégativité plus
élevée.
Exceptions :
- les hydrures, H combiné à un métal (NaH, LiH, KH,
…), n.o. = -I
- le
dihydrogène H2, n.o. = 0
Page 8.
Résumé. Accroissement du
n.o.
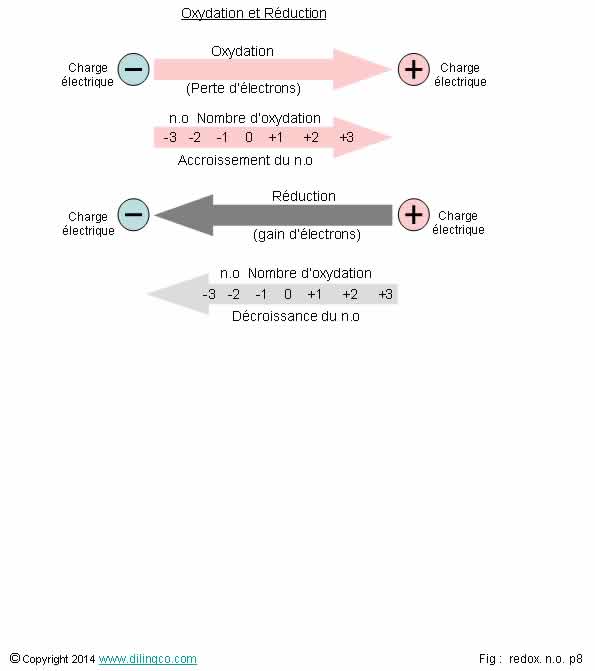
Sélectionner
l’affirmation exacte :
1-
Oxydation/réduction : l’une peut se faire sans l’autre
2- n.o=+1
inférieur à n.o=-2
3- Accroissement
du n.o = perte de charges négatives
4- Un
oxydant s’oxyde en réducteur
L’affirmation
3 est exacte.
Affirmation
4
Non.
Un oxydant se réduit en obtenant un électron.
Gain d’électrons = Réduction.
Page 5.
Calcul n.o. Cas général
Sélectionner
les quatre affirmations exactes :
1- [A] :
La somme des nombres d’oxydation des quatre atomes d’oxygène est égales à -8 (n.o
O=-VIII en chiffre romains)
2- [B] :
n.o Cl=+VII (+7 -8 = -1)
3- [C] :
L’oxygène est plus électronégatif que le chlore : il prend tous les
électrons de valence dans la structure ionique fictive
4- L’atome
de chlore isolé a 0 électrons de valence
5- [D] :
Atome d’oxygène isolé : 6 électrons de valence (n.o= Nv atome isolé + Nv
atome dans la structure ionique fictive)
6- Dans ClO-
le nombre d’oxydation du chlore est +II
Les
affirmations 1, 2, 3 et 5 sont exactes.
Affirmation
2
Oui.
Dans la
structure ClO4-, l’atome de chlore à un nombre d’oxydation de +7. Suivant le
calcul: -1, charge globale de la structure,
Affirmation
4
Non.
Figure :
nombre d’oxydation du chlore dans la structure =+VII
L’atome Cl
dans la structure ionique fictive n’a pas d’électrons à ajouter, l’atome isolé
a donc 7 électrons de valence.
Nombre
d’oxydation Cl= Nv atome isolé – Nv atome dans la structure fictive = +VII
(= +7 -0)
Affirmation
6
Non.
La charge totale de ClO est –I,
Le nombre
d’oxydation de l’oxygène est - II,
Le nombre
d’oxydation de Cl est donc +I
(-II +I = -I)
Rappels:
n.o : nombre d’oxydation
Loi de
calcul
La somme des nombres d’oxydation des divers atomes d’une structure
est égale à la charge globale de la structure.
Cas
général Oxygène & Hydrogène
Dans le
cas général :
- Le
nombre d’oxydation de l’oxygène est
égal à moins deux
(n.o O = -II)
- Le
nombre d’oxydation de l’hydrogène est
égal à plus un
(n.o H = +I)
Autres
atomes
Agir par déduction : soustraction des n.o des atomes oxygène &
hydrogène de la charge globale de la structure
Page 6.
Exceptions
Sélectionner
les deux affirmations exactes :
1- L’atome
d’oxygène attire toujours à lui les électrons des autres atomes
2- Dans
une liaison entre atomes oxygène/fluor, l’atome d’oxygène attire à lui les
électrons du fluor
3- [A] :
nombre d’oxydation du carbone = 0 (+II – II)
4- [B] :
dans H2O2, n.o oxygène = -II, n.o hydrogène =-I
5- [C] :
nombre d’oxydation de l’azote: -II
6- [C] :
nombre d’oxydation de l’azote: -III
7- Dans
l’ammoniac (NH3), le monoxyde d’azote (NO), de dioxyde d’azote (NO2), l’acide
nitrique (HNO3), l’atome d’azote a le même nombre d’oxydation
8- Dans
NH3, NO, NO2, HNO3, N est oxydé de la même manière
Les
affirmations 3 et 6 sont exactes.
Rappels :
Calcul.
Cas général
En
général, pour calculer le nombre d’oxydation, il n’y a pas à définir la
structure de Lewis et une hypothèse sur une structure ionique fictive.
Simplement
appliquer :
- La somme des nombres d’oxydation des divers atomes d’une
structure est égale à la charge globale de la structure.
- Nombre
d’oxydation, n.o O = -II,
- Nombre
d’oxydation, n.o H = +I,
En déduire le nombre d’oxydation recherché.
Exceptions
- L’atome
d’oxygène est lié à un atome de fluor,
Le fluor
est plus électronégatif que l’oxygène. Le fluor attire à lui les électrons des
atomes d’oxygène qui lui sont liés : le nombre d’oxydation de l’oxygène
n’est plus obligatoirement –II.
- L’atome
d’oxygène est lié à un autre atome d’oxygène.
- L’atome
d’hydrogène est lié à un atome moins électronégatif que lui.
Dans
ces cas :
La structure de Lewis, l’hypothèse d’une structure purement ionique,
sont à utiliser pour définir les nombres d’oxydation.
Page 7.
Placer les électrons redox
Sélectionner l’affirmation
exacte :
1- [A] :
Plus 2 électrons coté gauche de la demi équation
2- [A] :
Plus 2 électrons coté droit de la demi équation
3- [A] :
Plus un électron coté gauche de la demi équation
4- Dans ClO-
le nombre d’oxydation du chlore est +II
L’affirmation
1 est exacte.
Affirmation
3
Non.
Ne pas
oublier d’équilibrer les éléments chimiques avant de caluler les nombres
d’oxydation et d’équilibrer les charges.
Si
l’atome est seul :
- Dans un
corps simple moléculaire: n.O = 0,
- Dans un corps simple ionique : n.o = charge de l’ion.
Affirmation
4
Non.
La charge totale de ClO est –I,
Le nombre
d’oxydation de l’oxygène est – II dans
le cas général,
Le nombre
d’oxydation de Cl est donc : -II +I = -I.
Rappels :
Cas
simple
Il n’y a pas d’atome d’oxygène ou d’hydrogène dans
l’équation du couple redox :
La
connaissance des nombres d’oxydation permet de
définir le coté où placer les électrons dans les demi-équations rédox.
Procédure
1- équilibrer les éléments chimiques
2- placer les électrons en fonction des nombres d’oxydation
pour équilibrer les charges
Exemple
1
Étape
1 :
- L’équation
est déjà équilibré (un élément Chrome de chaque coté)
Étape 2 :
- Placer
les électrons en fonction des n.o
-
Définir les nombres d’oxydation
(Dans cet
exemple le n.o est directement égal à la charge de l’entité).
-
Rajouter les électrons, en nombre suffisant pour équilibrer et du coté où il y
a moins de n.O
(Plus
trois d’un coté, plus un de l’autre : rajouter 2 électrons, coté +I, pour
équilibrer)
Page 8.
Equilibrer une
demi-équation redox
Sélectionner
les quatre affirmations exactes :
1- [A] :
2 éléments chimiques chrome
2- [B] :
7 éléments chimiques oxygène apportés par 7 molécules d’eau
3-
[B] : 14 éléments chimiques oxygène
4-
[C] : 14 éléments chimiques hydrogène
5-
[C] : 7 éléments chimiques hydrogène
6-
[D] : 1 électrons
7-
[D] : 6 électrons
8-
[D] : 12 électrons
Les
affirmations 1, 2, 4 et 7 sont exactes.
Rappels :
Équilibrer
une demi équation redox c’est :
- Equilibrer le nombre d’éléments
chimiques,
- Equilibrer le nombre de charges électriques,
- Si l’oxydant contient des atomes d’oxygène :
-
Placer des ions H+ coté oxydant,
-
Placer des molécules d’eau coté réducteur.
Deux
procédures
Deux
procédures sont possibles pour équilibrer les demi équations redox.
Dans les
deux procédures, il faut commencer par équilibrer les nombres des éléments
chimiques.
Les deux procédures divergent sur l’étape des placements des électrons pour
équilibrer les charges électriques.
Placement
des électrons :
- Soit placer les
électrons au début, en fonction des nombres d’oxydation,
(À
utiliser pour les couples redox d’éléments chimiques simples)
- Soit en fin de
procédure lorsque tous les composants chimiques, oxygène et eau sont
placés et équilibrés.
Page 9.
Equilibrer une réaction
redox
Sélectionner
l’affirmation exacte :
1- [A] :
Erreur dans l’équilibrage des charges électriques
2- [A] :
Erreur dans l’équilibrage des éléments chromes
3- [A] :
Erreur dans l’équilibrage des oxygènes
4- [B] :
+ deux électrons dans chaque demi équations
5-
[C] : 3 Fe et 4 O2
L’affirmation
4 est exacte.
Rappels :
Pour
équilibrer une réaction d’oxydoréduction :
- Partir
des deux demi équations équilibrées,
- Faire
disparaître les électrons libres (qui n’existent pas en milieu aqueux), en multipliant chaque demi équation par le coefficient
approprié.
(Coefficient
égal au nombre d’électron de l’autre demi-équation)
Page 10.
Potentiel d’oxydo-réduction
Sélectionner
l’affirmation fausse :
1- La
connaissance des potentiels d’oxydoréduction permet de prévoir la réactivité
des espèces chimiques entre elles
2- L’ion
fluorure est un réducteur très fort (potentiel redox 2,87 volt)
3- Le difluor
est un oxydant très puissant (potentiel redox 2,87 volt)
. Il est
extrêmement réactif et corrosif
4- Dans
un couple redox : à un oxydant fort est conjugué un réducteur faible
L’affirmation
2 est fausse.
Rappels :
Un potentiel redox élevé définit un oxydant fort et un réducteur
faible.
Le potentiel d’oxydo-réduction,
noté E, permet d’affecter une force oxydante (ou inversement, de force réductrice),
et de classer les oxydants et les réducteurs sur une échelle de valeur.
Le
potentiel d’oxydo-réduction se mesure en volt.
Mesure
du potentiel redox
Le
potentiel d’oxydo-réduction d’un élément est exprimé sur une échelle d’origine 0 fixée par
convention sur le potentiel du couple proton/hydrogène
H+/H2.
La mesure
du potentiel d’un élément se fait en reliant deux demi-piles, l’une avec une
électrode normale à l’hydrogène ‘ENH’ (d’où parfois l’unité V/ENH, ‘volt / électrode normale à l’hydrogène’)
et l’autre est relative à l’élément à mesurer.
Le sens
du courant entre les demi-piles indique la force relative du potentiel et la tension sa valeur.
Le
potentiel d’électro-réduction d’un élément peut varier suivant les conditions
extérieures : température, pH, lumière, etc.
Page 11.
Règle du gamma
Sélectionner
les quatre affirmations exactes :
1- Une
réaction d’oxydoréduction est une réaction entre le réducteur d’un couple et
l’oxydant d’un autre couple
2- Une
réaction d’oxydoréduction est une réaction entre le réducteur et l’oxydant d’un
même couple redox
3- Par
convention, le potentiel d’oxydoréduction du couple H+/H2, a pour valeur 0
4- Règle
du gamma : l’oxydant le plus fort réagit avec le réducteur le plus faible
pour donner le réducteur le plus fort et l’oxydant le plus faible
5- À
l’équilibre, les couples redox ont le même potentiel d’oxydoréduction
6- Une
réaction redox peut être totale ou partielle
Les
affirmations 1, 3, 5 et 6 sont exactes.
Affirmation
4
Non.
Règle du
gamma :
L’oxydant le plus fort réagit avec le réducteur
le plus fort pour donner le réducteur et l’oxydant les plus faibles.
Rappels :
La règle
du gamma permet, en suivant le sens du signe, de prévoir quel oxydant va réagir
avec quel réducteur.
Pour appliquer la règle du gamma à la découverte du sens de
réaction il faut :
1- Connaître les couples redox impliqués,
2- Connaître le potentiel d’oxydoréduction de chaque couple.
Page 12.
Oxydation réduction redox
Sélectionner
les cinq affirmations exactes :
1-
Mnémotechnique : Le ‘R’ éducteur ‘R’end des électrons. L’Oxydant Obtient
des électrons
2- Un
oxydant se réduit ; un réducteur s’oxyde
3- Un
oxydant s’oxyde ; un réducteur se réduit
4- Lors
d’une redox, celui qui gagne des électrons est l’oxydant. (Oxydant =>
Obtient)
5-
[A] : exemple d’oxydation, [B] : exemple de réduction
6-
[C] : exact
7- Pas de
réaction d’oxydoréduction en biologie (la respiration cellulaire, la
biosynthèse des acides gras, du glucose, ne sont pas des réactions redox)
Les
affirmations 1, 2, 4, 5 et 6 sont exactes.
Quelques
exemples de réactions d’oxydoréduction en biochimie :
- La respiration aérobie,
Absorption
de dioxygène O2, rejet de dioxyde de carbone CO2,
- La respiration cellulaire, dégradation d’un élément
chimique (exemple glucose), grâce au dioxygène pour fournir l’énergie.
- La fermentation lactique ou alcoolique,
- Une
combustion est une réaction chimique exothermique d’oxydoréduction.
Affirmation
1
Oui.
Le Réducteur Rend
des électrons.
L’Oxydant Obtient
des électrons.
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Nombre d’oxydation

Sélectionner l’affirmation exacte :
1- Calculer le nombre d’oxydation est indispensable pour équilibrer une réaction d’oxydoréduction
2- Le nombre d’oxydation (n.o.) est la charge électrique réelle ou fictive d’un élément chimique
3- Le nombre d’oxydation d’un ion est nul
4- Le nombre d’oxydation d’une molécule est différent de 0
L’affirmation 2 est exacte.
Affirmation 1
Non.
2 méthodes sont à disposition pour équilibrer une réaction d’oxydoréduction.
Les 2 méthodes donnent le même résultat.
Utiliser le n.o. pour équilibrer une réaction d’oxydoréduction n’est donc pas indispensable.
Mais, dans une équation chimique, une variation du nombre d’oxydation indique à coup sûr qu’il s’agit d’une réaction d’oxydation.
Le n.o.
permet aussi de déterminer l’élément qui s’oxyde.
(élément qui s’oxyde = réducteur)
Affirmation 2
Oui.
Le nombre d’oxydation (n.o.) :
- aussi appelé « degré d’oxydation », d.o.
- se note conventionnellement en chiffres romains,
- est la charge électrique réelle ou fictive d’un élément chimique,
- peut apparaître dans les annotations:
Oxyde de fer (II) : FeO, le fer a un n.o. = II
Oxyde de fer (III) : Fe2O3, le fer a un n.o. = III
Ces exemples montrent qu’un même atome peut avoir plusieurs valeurs de n.o. selon la molécule où il se trouve.
Affirmation 3
Non.
Le nombre d’oxydation d’un ion est égal à sa charge électrique.
Exemples :
Cr3+, n.o. = III
CIO4-, n.o. = I
Affirmation 4
Non.
Une molécule n’a pas de charge électrique : Le nombre d’oxydation d’une molécule est nul.
Page 2.
Calcul du n.o. Atomes O & H

Sélectionner les deux affirmations exactes :
1- [A]. La somme algébrique des n.o. des atomes d’une molécule est nulle
2- [A]. La somme algébrique des n.o. des atomes d’un ion est nulle
3- [B]. Sauf exceptions, n.o. de l’oxygène dans les composés oxygénés est égal à –II
4- Sauf exceptions, n.o. de l’hydrogène dans les composés hydrogénés est égal à –II
5- Hypothèse pour déterminer le nombre d’oxydation des éléments d’une molécule : toutes les liaisons sont des liaisons covalentes
6- Nombre d’oxydation du fluor = 0
Les affirmations 1 et 3 sont exactes.
Se rappeler :
n.o. molécule = 0
n.o. ion = charge de l’ion
Affirmation 1
Oui.
[A]. Le n.o. d’une molécule est nul.
La charge globale d’une molécule est nulle : La somme algébrique des n.o des atomes d’une molécule est nulle.
Exemples :
n.o. H2O = 0 = 2H (+I) + O ( -II)
n.o. H2, CH4, NaCl, H2SO4, CH3COOH, … = 0
Affirmation 4
Non.
[A]. Le nombre d’oxydation d’un ion est égal à la charge de l’ion.
Affirmation 3
Oui.
[B]. Composés oxygénés :
Le n.o. de l’atome d’oxygène est égal à –II
Exceptions :
- les peroxydes (H2O2, Na2O2, K2O2, …), n.o. = -I.
- le dioxygène O2, n.o. = 0
Règle à savoir par cœur
(Mnémotechnique : se rappeler le cas de la molécule d’eau).
Affirmation 4
Non.
[B]. Composés hydrogénés :
Le n.o. de l’atome d’hydrogène est égal à +I.
n.o =+I car les atomes d’hydrogène, moins électronégatifs, cèdent leur e- aux atomes liés d’électronégativité plus élevée.
Exceptions :
- les hydrures, H combiné à un métal (NaH, LiH, KH, …), n.o. = -I
- le dihydrogène H2, n.o. = 0
Règle à savoir par cœur.
(Mnémotechnique : se rappeler le cas de la molécule d’eau).
Affirmation 5
Non.
Le nombre d’oxydation (appelé aussi degré d’oxydation) = charge électrique supplémentaire que porterait un atome si toutes les liaisons de la molécule étaient des liaisons ioniques.
Dans une liaison ionique, l’atome le plus électronégatif attire l’électron de l’atome le moins électronégatif.
Exemple figure, molécule d’eau : O attire les 2 électrons des atomes d’hydrogène, son électronégativité est de -2
2 électrons de plus = -II
Hydrogène : 1 électron de moins = +I
Affirmation 6
Non.
Nombre d’oxydation du fluor = -1
(Toujours)
Page 3.
n.o. des éléments chimiques

Sélectionner l’affirmation exacte :
1- [A]. La réaction n’est pas une réaction d’oxydoréduction
2- [B]. Atome d’oxygène n.o. = -6
3- [C]. Nombre d’oxydation de l’atome de soufre = +6
4- [D]. CO est l’oxydant
L’affirmation 3 est exacte.
Une oxydation est une augmentation du n.o. du réducteur.
Une réduction est une diminution du n.o. de l’oxydant.
Affirmation 1
Si.
[A]. La réaction est une réaction d’oxydoréduction : les nombres d’oxydation changent de part et d’autre de l’équation.
L’hydrogène a perdu un électron (n.o. augmente).
C’est le réducteur (réducteur « rend »), il s’est oxydé.
L’oxygène a gagné 2 électrons (n.o. diminue de 2 charges)
Affirmation 2
Non.
[B]. Atome d’oxygène n.o. = -2
Dans les composés oxygénés, le n.o. de l’atome d’oxygène est égal à –II.
Exceptions :
- les peroxydes (H2O2, Na2O2, K2O2, …), n.o. = -I.
- le dioxygène O2, n.o. = 0
Règle à savoir par cœur
(Mnémotechnique : se rappeler le cas de la molécule d’eau).
Affirmation 4
Non.
CO est le réducteur.
Pour déterminer dans les réactifs quel est l’oxydant et quel est le réducteur, il faut trouver les n.o. et déterminer leurs évolutions.
C passe
de +2 à gauche à +4 à droite : il a rendu 2 charges e-.
CO qui le contient est donc le réducteur ; réducteur « rend ».
Fe passe
de +3 à gauche à 0 à droite (corps simple) : il a gagné des charges e-.
Fe2O3 qui le contient est donc l’oxydant.
n.o. Fe, à gauche, à calculer : 0=2(Fe) + 3(-2)
Page 4.
n.o. par représentations de Lewis

Sélectionner l’affirmation exacte :
1- [A]. 8 électrons de valence et 6 électrons de charge fictive : différence = 2. N.o. de l’atome O = -2 dans la molécule de dioxygène
2- N.o de l’atome d’oxygène dans l’eau oxygénée = -I
3- [B]. Sauf exception, le nombre d’oxydation d’un atome d’oxygène = -I
4- La charge formelle d’un ion est toujours portée par un des atomes
L’affirmation 2 est exacte.
Affirmation 1
Non.
[A]. 6 électrons de valence et non 8.
Seuls les électrons de la couche externe sont à prendre en compte pour déterminer les électrons de valence.
N.o. de l’atome d’oxygène = 0 :
(6 charge fictives – 6 électrons de valence = 0)
Affirmation 2
Oui.
L’eau oxygénée (ou peroxyde d’hydrogène) H2O2 est un peroxyde
n.o de l’atome d’oxygène dans les peroxydes = -I
(Voir figure)
no de l’atome d’oxygène dans le dioxygène = 0.
Les propriétés oxydantes fortes de l’eau oxygénée en font un antiseptique et un stérilisant.
Affirmation 3
Non.
Composés oxygénés : le n.o. de l’atome d’oxygène est égal à –II
Exceptions :
- les peroxydes (H2O2, Na2O2, K2O2, …), n.o. = -I.
- le dioxygène O2, n.o. = 0
Règle à savoir par cœur
(Mnémotechnique : se rappeler le cas de la molécule d’eau).
Affirmation 4
Non.
La charge formelle d’un ion n’est pas toujours assignée à un de ses atomes.
Exemple figure : les 2 charges négatives de l’ion thiosulfate résultent de la somme algébrique des charges formelles ; elles sont délocalisées.
Règles de calcul du nombre d’oxydation
- Nombre d’oxydation d’un atome dans un composé chimique = charge fictive de l’atome si toutes les liaisons étaient des liaisons ioniques.
- Liaisons ioniques : tous les doublets sont attirés par l’atome le plus électronégatif.
- Si les 2 atomes d’une liaison ionique ont la même électronégativité, ils se partagent le doublet (1 électron attiré par chacun des 2 atomes).
Nombre d’oxydation = électrons de valence - charge fictive
Si la différence est nulle, n.o. de l’atome dans la molécule =0
Page 5.
n.o. fractionnaires ou erronés

Sélectionner l’affirmation exacte :
1- n.o. des atomes = 0 dans : Cu, Fe, N2, Br2, P4, …, et H2, et O2, O3
2- On ne peut pas trouver par calcul un nombre d’oxydation fractionnaire
3- [A]. Le n.o calculé du soufre (n.o. = +2) correspond à la réalité
4- [B]. Dans H2O, les n.o. des atomes d’hydrogène et d’oxygène sont nuls
L’affirmation 1 est exacte.
Affirmation 1
Oui.
Atomes de corps simples, n.o.= 0 :
- Cu, Fe, N2, Br2, P4, …,
- H2, O2, O3
… et n.o H=+1 dans les composés hydrogénés sauf les hydrures métalliques (où n.o. H=-1) NaH, CaH2, ...
… et n.o. O= -2 dans les composés oxygénés sauf les peroxydes (H2O2, …, O22-) où le n.o.= -1
… et n.o. du fluor = -1 (il est l’élément le plus électronégatif du tableau périodique).
Le n.o. de l’atome d’oxygène peut être égal à 0, -1, -2
Le n.o. de l’atome d’hydrogène peut être égal à 0, +1, -1
Affirmation 2
Si.
Exemple Pb dans Pb3O4, n.o. Pb= 8/3
Le n.o fractionnaire obtenu correspond à la moyenne de plombs oxydés à plusieurs degrés.
Affirmation 3
Non. [A].
Dans l’ion thiosulfate S2O32−, un atome de soufre à :
- un n.o. = +5
- un n.o. = -1
- pas de soufre avec n.o.=+2
Le n.o
calculé du soufre (n.o. = +2) ne correspond pas à la réalité.
Pour des structures complexes, la méthode de la représentation de Lewis pour
trouver le n.o. est plus sûre que le simple calcul.
Note :
L’ion thiosulfate se « dismute » : il apparaît dans 2 couples redox différents et joue le rôles de réducteur ou d’oxydant selon les cas.
- S2O32− (aq) / S (s)
- SO2 (aq) / S2O32−(aq)
Affirmation 4
Non.
[B]. Dans H2O :
- n.o. des atomes d’hydrogène = +I
- n.o. des atomes d’oxygène = -II
L’atome d’oxygène plus électronégatif que les atomes d’hydrogène attire l’atome de chacun.
A se rappeler les n.o. dans H2O
Page 6.
Résumé. n.o. Oxydation et réduction

Sélectionner l’affirmation exacte :
1- [A]. L’atome de carbone est l’oxydant
2- [B]. Oxydation = perte d’électron par le réducteur
3- [C]. Formaldehyde et acide formique : nombre d’oxydation du carbone = 2
4- Acide formique = formaldéide réduit
L’affirmation 2 est exacte.
Affirmation 1
Non.
[A]. L’atome de carbone perd (« rend ») des électrons, il est le réducteur.
Affirmation 3
Non.
[C].
Formaldehyde :
0 = (-2) + C + 2 (+1)
(n.o. molécule = n.o. oxygène + n.o. carbone + n.o hydrogènes)
N.o. carbone = 0
En représentation topologique, l’atome de carbone, à l’interception ou à l’angle de 2 traits, n’est pas mentionné.
Acide formique :
0= 2(-2) + C + 2(+1)
N.o. carbone = +2
Affirmation 4
Non.
L’atome de carbone dans l’acide formique a un nombre d’oxydation plus positif que celui de l’atome de carbone dans le formaldéide : il a perdu des électrons.
Il s’agit d’une oxydation = perte d’électron par le réducteur.
Acide formique = formaldéide oxydé.
Page 7.
Résumé. n.o.

Sélectionner l’affirmation exacte :
1- [A]. N.o. atome d’oxygène dans un élément chimique = -I
2- [B]. N.o. atome chlore = +VIII
3- [C]. N.o. atome d’azote = +III
4- Oxydation de l’azote. L’azote est le réducteur. Il s’est oxydé en rendant des charges. Accroissement du n.o. par perte d’électrons
L’affirmation 4 est exacte.
Affirmation 2
Non.
Ne pas oublier la charge négative de l’ion.
Affirmation 3
Oui.
0= N + 3(+1)
N.O. azote = -III
Affirmation 4
Oui.
Une oxydation est une augmentation du n.o. du réducteur.
Une réduction est une diminution du n.o. de l’oxydant.
Règle à savoir par cœur
(Mnémotechnique : se rappeler le cas de la molécule d’eau).
Composés oxygénés :
Le n.o. de l’atome d’oxygène est égal à –II
Exceptions :
- les peroxydes (H2O2, Na2O2, K2O2, …), n.o. = -I.
- le dioxygène O2, n.o. = 0
Composés hydrogénés :
Le n.o. de l’atome d’hydrogène est égal à +I.
n.o =+I car les atomes d’hydrogène, moins électronégatifs, cèdent leur e- aux atomes liés d’électronégativité plus élevée.
Exceptions :
- les hydrures, H combiné à un métal (NaH, LiH, KH, …), n.o. = -I
- le dihydrogène H2, n.o. = 0
Page 8.
Résumé. Accroissement du n.o.

Sélectionner l’affirmation exacte :
1- Oxydation/réduction : l’une peut se faire sans l’autre
2- n.o=+1 inférieur à n.o=-2
3- Accroissement du n.o = perte de charges négatives
4- Un oxydant s’oxyde en réducteur
L’affirmation 3 est exacte.
Affirmation 4
Non.
Un oxydant se réduit en obtenant un électron.
Gain d’électrons = Réduction.
Page 5.
Calcul n.o. Cas général
Sélectionner les quatre affirmations exactes :
1- [A] : La somme des nombres d’oxydation des quatre atomes d’oxygène est égales à -8 (n.o O=-VIII en chiffre romains)
2- [B] : n.o Cl=+VII (+7 -8 = -1)
3- [C] : L’oxygène est plus électronégatif que le chlore : il prend tous les électrons de valence dans la structure ionique fictive
4- L’atome de chlore isolé a 0 électrons de valence
5- [D] : Atome d’oxygène isolé : 6 électrons de valence (n.o= Nv atome isolé + Nv atome dans la structure ionique fictive)
6- Dans ClO- le nombre d’oxydation du chlore est +II
Les affirmations 1, 2, 3 et 5 sont exactes.
Affirmation 2
Oui.
Dans la structure ClO4-, l’atome de chlore à un nombre d’oxydation de +7. Suivant le calcul: -1, charge globale de la structure,
Affirmation 4
Non.
Figure : nombre d’oxydation du chlore dans la structure =+VII
L’atome Cl dans la structure ionique fictive n’a pas d’électrons à ajouter, l’atome isolé a donc 7 électrons de valence.
Nombre d’oxydation Cl= Nv atome isolé – Nv atome dans la structure fictive = +VII
(= +7 -0)
Affirmation 6
Non.
La charge totale de ClO est –I,
Le nombre d’oxydation de l’oxygène est - II,
Le nombre d’oxydation de Cl est donc +I
(-II +I = -I)
Rappels:
n.o : nombre d’oxydation
Loi de calcul
La somme des nombres d’oxydation des divers atomes d’une structure est égale à la charge globale de la structure.
Cas général Oxygène & Hydrogène
Dans le cas général :
- Le nombre d’oxydation de l’oxygène est égal à moins deux
(n.o O = -II)
- Le nombre d’oxydation de l’hydrogène est égal à plus un
(n.o H = +I)
Autres atomes
Agir par déduction : soustraction des n.o des atomes oxygène & hydrogène de la charge globale de la structure
Page 6.
Exceptions
Sélectionner les deux affirmations exactes :
1- L’atome d’oxygène attire toujours à lui les électrons des autres atomes
2- Dans une liaison entre atomes oxygène/fluor, l’atome d’oxygène attire à lui les électrons du fluor
3- [A] : nombre d’oxydation du carbone = 0 (+II – II)
4- [B] : dans H2O2, n.o oxygène = -II, n.o hydrogène =-I
5- [C] : nombre d’oxydation de l’azote: -II
6- [C] : nombre d’oxydation de l’azote: -III
7- Dans l’ammoniac (NH3), le monoxyde d’azote (NO), de dioxyde d’azote (NO2), l’acide nitrique (HNO3), l’atome d’azote a le même nombre d’oxydation
8- Dans NH3, NO, NO2, HNO3, N est oxydé de la même manière
Les affirmations 3 et 6 sont exactes.
Rappels :
Calcul. Cas général
En général, pour calculer le nombre d’oxydation, il n’y a pas à définir la structure de Lewis et une hypothèse sur une structure ionique fictive.
Simplement appliquer :
- La somme des nombres d’oxydation des divers atomes d’une structure est égale à la charge globale de la structure.
- Nombre d’oxydation, n.o O = -II,
- Nombre d’oxydation, n.o H = +I,
En déduire le nombre d’oxydation recherché.
Exceptions
- L’atome d’oxygène est lié à un atome de fluor,
Le fluor est plus électronégatif que l’oxygène. Le fluor attire à lui les électrons des atomes d’oxygène qui lui sont liés : le nombre d’oxydation de l’oxygène n’est plus obligatoirement –II.
- L’atome d’oxygène est lié à un autre atome d’oxygène.
- L’atome d’hydrogène est lié à un atome moins électronégatif que lui.
Dans ces cas :
La structure de Lewis, l’hypothèse d’une structure purement ionique, sont à utiliser pour définir les nombres d’oxydation.
Page 7.
Placer les électrons redox
Sélectionner l’affirmation
exacte :
1- [A] : Plus 2 électrons coté gauche de la demi équation
2- [A] : Plus 2 électrons coté droit de la demi équation
3- [A] : Plus un électron coté gauche de la demi équation
4- Dans ClO- le nombre d’oxydation du chlore est +II
L’affirmation 1 est exacte.
Affirmation 3
Non.
Ne pas oublier d’équilibrer les éléments chimiques avant de caluler les nombres d’oxydation et d’équilibrer les charges.
Si l’atome est seul :
- Dans un corps simple moléculaire: n.O = 0,
- Dans un corps simple ionique : n.o = charge de l’ion.
Affirmation 4
Non.
La charge totale de ClO est –I,
Le nombre d’oxydation de l’oxygène est – II dans le cas général,
Le nombre d’oxydation de Cl est donc : -II +I = -I.
Rappels :
Cas simple
Il n’y a pas d’atome d’oxygène ou d’hydrogène dans l’équation du couple redox :
La connaissance des nombres d’oxydation permet de définir le coté où placer les électrons dans les demi-équations rédox.
Procédure
1- équilibrer les éléments chimiques
2- placer les électrons en fonction des nombres d’oxydation pour équilibrer les charges
Exemple 1
Étape 1 :
- L’équation est déjà équilibré (un élément Chrome de chaque coté)
Étape 2 :
- Placer les électrons en fonction des n.o
- Définir les nombres d’oxydation
(Dans cet exemple le n.o est directement égal à la charge de l’entité).
- Rajouter les électrons, en nombre suffisant pour équilibrer et du coté où il y a moins de n.O
(Plus trois d’un coté, plus un de l’autre : rajouter 2 électrons, coté +I, pour équilibrer)
Page 8.
Equilibrer une demi-équation redox
Sélectionner les quatre affirmations exactes :
1- [A] : 2 éléments chimiques chrome
2- [B] : 7 éléments chimiques oxygène apportés par 7 molécules d’eau
3- [B] : 14 éléments chimiques oxygène
4- [C] : 14 éléments chimiques hydrogène
5- [C] : 7 éléments chimiques hydrogène
6- [D] : 1 électrons
7- [D] : 6 électrons
8- [D] : 12 électrons
Les affirmations 1, 2, 4 et 7 sont exactes.
Rappels :
Équilibrer une demi équation redox c’est :
- Equilibrer le nombre d’éléments chimiques,
- Equilibrer le nombre de charges électriques,
- Si l’oxydant contient des atomes d’oxygène :
- Placer des ions H+ coté oxydant,
- Placer des molécules d’eau coté réducteur.
Deux procédures
Deux procédures sont possibles pour équilibrer les demi équations redox.
Dans les
deux procédures, il faut commencer par équilibrer les nombres des éléments
chimiques.
Les deux procédures divergent sur l’étape des placements des électrons pour
équilibrer les charges électriques.
Placement des électrons :
- Soit placer les électrons au début, en fonction des nombres d’oxydation,
(À utiliser pour les couples redox d’éléments chimiques simples)
- Soit en fin de procédure lorsque tous les composants chimiques, oxygène et eau sont placés et équilibrés.
Page 9.
Equilibrer une réaction redox
Sélectionner l’affirmation exacte :
1- [A] : Erreur dans l’équilibrage des charges électriques
2- [A] : Erreur dans l’équilibrage des éléments chromes
3- [A] : Erreur dans l’équilibrage des oxygènes
4- [B] : + deux électrons dans chaque demi équations
5- [C] : 3 Fe et 4 O2
L’affirmation 4 est exacte.
Rappels :
Pour équilibrer une réaction d’oxydoréduction :
- Partir des deux demi équations équilibrées,
- Faire disparaître les électrons libres (qui n’existent pas en milieu aqueux), en multipliant chaque demi équation par le coefficient approprié.
(Coefficient égal au nombre d’électron de l’autre demi-équation)
Page 10.
Potentiel d’oxydo-réduction
Sélectionner l’affirmation fausse :
1- La connaissance des potentiels d’oxydoréduction permet de prévoir la réactivité des espèces chimiques entre elles
2- L’ion fluorure est un réducteur très fort (potentiel redox 2,87 volt)
3- Le difluor est un oxydant très puissant (potentiel redox 2,87 volt)
. Il est extrêmement réactif et corrosif
4- Dans un couple redox : à un oxydant fort est conjugué un réducteur faible
L’affirmation 2 est fausse.
Rappels :
Un potentiel redox élevé définit un oxydant fort et un réducteur faible.
Le potentiel d’oxydo-réduction, noté E, permet d’affecter une force oxydante (ou inversement, de force réductrice), et de classer les oxydants et les réducteurs sur une échelle de valeur.
Le potentiel d’oxydo-réduction se mesure en volt.
Mesure du potentiel redox
Le potentiel d’oxydo-réduction d’un élément est exprimé sur une échelle d’origine 0 fixée par convention sur le potentiel du couple proton/hydrogène H+/H2.
La mesure du potentiel d’un élément se fait en reliant deux demi-piles, l’une avec une électrode normale à l’hydrogène ‘ENH’ (d’où parfois l’unité V/ENH, ‘volt / électrode normale à l’hydrogène’) et l’autre est relative à l’élément à mesurer.
Le sens du courant entre les demi-piles indique la force relative du potentiel et la tension sa valeur.
Le potentiel d’électro-réduction d’un élément peut varier suivant les conditions extérieures : température, pH, lumière, etc.
Page 11.
Règle du gamma
Sélectionner les quatre affirmations exactes :
1- Une réaction d’oxydoréduction est une réaction entre le réducteur d’un couple et l’oxydant d’un autre couple
2- Une réaction d’oxydoréduction est une réaction entre le réducteur et l’oxydant d’un même couple redox
3- Par convention, le potentiel d’oxydoréduction du couple H+/H2, a pour valeur 0
4- Règle du gamma : l’oxydant le plus fort réagit avec le réducteur le plus faible pour donner le réducteur le plus fort et l’oxydant le plus faible
5- À l’équilibre, les couples redox ont le même potentiel d’oxydoréduction
6- Une réaction redox peut être totale ou partielle
Les affirmations 1, 3, 5 et 6 sont exactes.
Affirmation 4
Non.
Règle du gamma :
L’oxydant le plus fort réagit avec le réducteur le plus fort pour donner le réducteur et l’oxydant les plus faibles.
Rappels :
La règle du gamma permet, en suivant le sens du signe, de prévoir quel oxydant va réagir avec quel réducteur.
Pour appliquer la règle du gamma à la découverte du sens de réaction il faut :
1- Connaître les couples redox impliqués,
2- Connaître le potentiel d’oxydoréduction de chaque couple.
Page 12.
Oxydation réduction redox
Sélectionner les cinq affirmations exactes :
1- Mnémotechnique : Le ‘R’ éducteur ‘R’end des électrons. L’Oxydant Obtient des électrons
2- Un oxydant se réduit ; un réducteur s’oxyde
3- Un oxydant s’oxyde ; un réducteur se réduit
4- Lors d’une redox, celui qui gagne des électrons est l’oxydant. (Oxydant => Obtient)
5- [A] : exemple d’oxydation, [B] : exemple de réduction
6- [C] : exact
7- Pas de réaction d’oxydoréduction en biologie (la respiration cellulaire, la biosynthèse des acides gras, du glucose, ne sont pas des réactions redox)
Les affirmations 1, 2, 4, 5 et 6 sont exactes.
Quelques exemples de réactions d’oxydoréduction en biochimie :
- La respiration aérobie,
Absorption de dioxygène O2, rejet de dioxyde de carbone CO2,
- La respiration cellulaire, dégradation d’un élément chimique (exemple glucose), grâce au dioxygène pour fournir l’énergie.
- La fermentation lactique ou alcoolique,
- Une combustion est une réaction chimique exothermique d’oxydoréduction.
Affirmation 1
Oui.
Le Réducteur Rend des électrons.
L’Oxydant Obtient des électrons.